Введение
Согласно данным Всемирной организации здравоохранения сердечно-сосудистые заболевания (ССЗ) являются причиной смерти примерно 20,5 миллионов человек ежегодно, что составляет около одной трети всех летальных исходов [1]. К перечню наиболее распространенных заболеваний сердечно-сосудистой системы относятся ишемическая болезнь сердца, артериальная гипертензия, сердечная недостаточность, острый коронарный синдром. Коррекция ССЗ проходит наиболее эффективно на ранних стадиях заболевания, поэтому требуются новые подходы к диагностике, которые позволяли бы выявлять признаки заболевания до появления клинических признаков. Помимо этого, отслеживание клинических показателей пациентов с установленным диагнозом необходимо для подбора эффективного лечения и оценки рисков. Одним из перспективных методов диагностики является метаболомное профилирование – анализ низкомолекулярных эндогенных соединений (метаболитов) в биологических жидкостях организма. Метаболом, определяемый как совокупность всех метаболитов, присутствующих в организме, представляет собой ключевой индикатор его функционального состояния [2, с. 151-174]. Исследования метаболома позволяют не только выявлять изменения в метаболических процессах, но и прогнозировать развитие заболеваний на ранних стадиях, когда клинические симптомы еще не проявляются [3, с. 108-120]. Данный подход делает метаболомный анализ ценным инструментом для диагностики и мониторинга сердечно-сосудистых заболеваний, предоставляя врачам возможность принимать более обоснованные решения в отношении профилактики и лечения [4]. В результате использования метаболомных исследований можно существенно улучшить исходы терапии и повысить качество жизни пациентов.
В метаболомике различают два основных подхода: целевой и панорамный, каждый из которых используется для решения различных исследовательских задач [5]. Панорамная метаболомика включает в себя анализ всего спектра метаболитов в образце. Такой метод помогает в поиске новых метаболитов и биохимических путей, что, в свою очередь, способствует формированию новых научных гипотез о метаболических процессах в организме. Целевой анализ подразумевает количественное или полуколичественное определение группы известных метаболитов. Этот подход позволяет установить диапазон физиологической нормы, что способствует дальнейшему применению целевого анализа в диагностике и прогнозировании. В отличие от панорамного анализа, целевой подход более специфичен и может быть более чувствительным к изменениям уровней определенных метаболитов, что делает его полезным инструментом в клинической практике.
Для разработки инструментов диагностики, основанных на метаболомном профилировании, необходимо изучить, какие биохимические процессы организма отражают здоровье сердечно-сосудистой системы. Выявленные метаболиты могут стать основой для разработки диагностических тест-систем. Цель данного обзора – выделить основные метаболические пути и метаболиты, которые изменяются при развитии ССЗ.
Метаболизм триптофана
Метаболизм триптофана включает в себя три основных пути: кинурениновый, серотониновый и индоловый. Кинурениновый путь играет ключевую роль в регуляции иммунного ответа и развитии воспалительного процесса, что особенно важно для ряда заболеваний сердечно-сосудистой системы. Фермент индоламин-2,3-диоксигеназа (ИДО), катализирующий превращение триптофана в кинуренин, продуцируется эндотелиальными клетками в стенках артерий [6, с. 112-115; 7, с. 482-491], клетками гладкой мускулатуры, макрофагами и лейкоцитами [8, с. 55-63; 9, с. 3959-3961]. Провоспалительные цитокины интерлейкины IL-1 и IL-2 также индуцируют экспрессию фермента [10, с. 137-143]. Повышенные уровни метаболитов кинуренинового пути – кинуренин, антраниловая кислота, 3-гидроксикинуренин и ксантуреновая кислота – были ассоциированы с повышенным риском смертности от ССЗ [11, с. 249-258]. В частности, было показано, что 3-гидроксиантранилловая кислота оказывает кардиотоксичный эффект и способствует развитию воспалительного процесса в стенках сосудов, что способствует эндотелиальной дисфункции [12, с. 934-949].
К метаболитам серотонинового пути метаболизма триптофана относятся серотонин и мелатонин. Серотонин, помимо выполнения роли нейромедиатора в центральной нервной системе, также участвует в регуляции сосудистого тонуса [13, с. 44-48], моторики кишечника [14, с. 319-331], гемостаза [15, с. 356-359] и иммунных реакций [16, с. 561-574; 17, с. 514-526; 18, с. 11-16] в периферических тканях. Серотониновые рецепторы широко представлены в сердечно-сосудистой системе, поэтому серотонин играет значительную роль в патофизиологии сердечно-сосудистых заболеваний. Известно, что при артериальной гипертензии [19, с. 195-209], атеросклерозе сонных артерий [20, с. 153-159] или ишемической болезни сердца [21, с. 483-489; 22, с. 116-124] наблюдаются повышенные концентрации серотонина. Роль мелатонина заключается в прямом влиянии на нервную систему и косвенном влиянии на кровеносные сосуды и сердце [23; 24, с. 79-83; 25]. Так, было обнаружено значительное снижение концентрации мелатонина в группе пациентов с ишемической болезнью сердца в сравнении со здоровыми добровольцами [26].
Катаболизм триптофана по индоловому пути происходит с участием микроорганизмов кишечника, где под действием бактериальных ферментов образуются триптамин и индоловые кислоты. Метаболиты индолового пути обеспечивают гомеостаза кишечника путем обновления эпителия, обеспечивания целостности эпителиального барьера и регуляции иммунных реакций. Было показано, что индол-уксусная кислота ингибирует образование кинуренина и стимулирует образование ксантуреновой и 3-гидроксиуксусной кислоты [27].
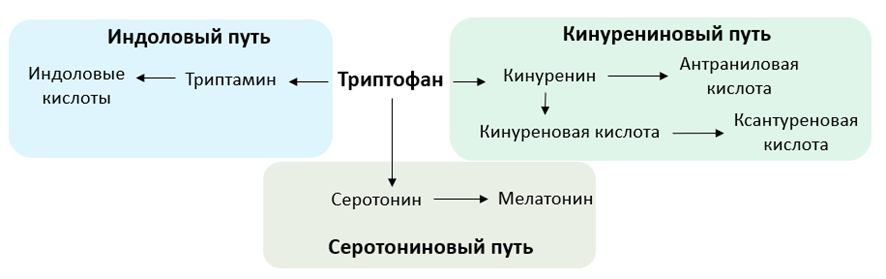
Рис. 1. Биохимические пути катаболизма триптофана
Обмен ацилкарнитинов
Ацилкарнитины являются эфирами карнитина, которые образуются при связывании карнитина с жирными кислотами. Они являются транспортной формой жирных кислот в митохондрии для последующего окисления. Результатом изменения митохондриального обмена и неэффективного окисления жирных кислот может стать ишемическая болезнь сердца. Высокие концентрации ацилкарнитинов оказывают токсическое действие на миокард и кровеносные сосуды, что вносит вклад в прогрессирование ССЗ [28, с. 1513-1524; 29, с. 755-768]. Ацилкарнитины участвуют в генерации импульсов, приводящих к сокращению сердечной мышцы [30]. Дисбаланс этих метаболитов может приводить к нарушениям проводимости сердца и ухудшению кровоснабжения организма в целом.
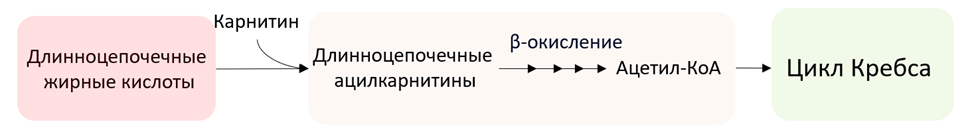
Рис. 2. Метаболизм длинноцепочечных ацилкарнитинов
Цикл мочевины
Цикл мочевины, или орнитиновый цикл, – это метаболический путь детоксикации аммиака в печени [31, с. 634-645]. Основными метаболитами данного цикла являются аргинин, цитруллин, орнитин и его производные (спермидин, пролин и путресцин). В одном из проспективных когортных исследований было установлено, что повышенный уровень цитруллина в плазме ассоциируется с увеличением вероятности серьезных неблагоприятных последствий, таких как смерть, инфаркт миокарда и инсульт [32, с. 2061-2067]. В исследовании [33] у пациентов с инсультом был зафиксирован более высокий уровень аргинина, пролина и спермидина в плазме по сравнению с контрольной группой.
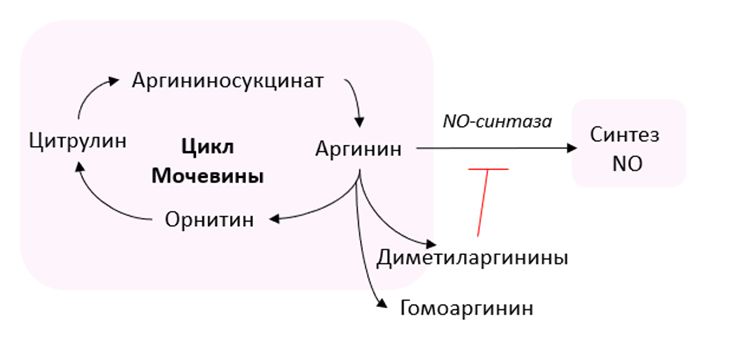
Рис. 3. Орнитиновый цикл
Метаболизм аргинина и его производных
Аминокислота аргинин не только входит в состав белков и участвует в цикле мочевины, но и служит прекурсором для синтеза оксида азота (NO) при участии фермента NO-синтазы. Оксид азота играет ключевую роль в регуляции сосудистого тонуса путем расслабления гладкой мускулатуры сосудов и их последующей дилатации [39]. Недостаточная концентрация NO может привести к артериальной гипертензии [34, с. 19-22] и другим кардиоваскулярным заболеваниям. Вклад метилированных производных, а именно монометиларгинина (ММА), симметричного (СДМА) и асимметричного (АДМА) диметиларгининов в развитие кардиопатологий обусловлен их способностью ингибировать синтез оксида азота [33]. Высокая концентрация метиларгининов в условиях низкого уровня NO может вызывать сосудистое воспаление, окисление липопротеинов низкой плотности, образование свободных радикалов и агрегацию тромбоцитов на эндотелиальных клетках сосудов [35, с. 1040-1046; 36, с. 170-174; 37, с. 273-284; 38, с. 887-894].
Недавние исследования подчеркивают возможную значимость гомоаргинина, эндогенной непротеиногенной аминокислоты, для здоровья сердечно-сосудистой системы [40, с. 519-529]. Низкие уровни L-гомоаргинина ассоциированы с неблагоприятными кардиоваскулярными последствиями и повышенной смертностью, что может быть связано с его ролью в синтезе оксида азота, обусловленной структурным сходством с аргинином.
Обмен аминокислот с разветвлёнными боковыми цепями (BCAA)
Аминокислоты с разветвленной цепью (BCAA), включая лейцин, изолейцин и валин, оказывают значительное влияние на состояние сердечно-сосудистой системы. BCAA регулируют синтез белка, чувствительность к инсулину и обмен глюкозы. Дисфункция метаболизма BCAA ассоциируется с такими состояниями, как ожирение, инсулинорезистентность и диабет 2 типа, которые являются важными факторами риска сердечно-сосудистых заболеваний. Наблюдается значительная связь между повышенным уровнем BCAA и риском развития сердечно-сосудистых заболеваний, что происходит независимо от традиционных факторов риска [41]. Данные позволяют предположить, что BCAA могут оказывать прямое влияние на патогенез кардиоваскулярных заболеваний.
Заключение
Для разработки метаболомного подхода для диагностики ССЗ требуется сформировать панель определяемых метаболитов, имеющих решающее значение для рассматриваемой патологии. В настоящем обзоре описана роль метаболических путей и определенных метаболитов, которые либо изменяются при развитии кардиологических заболеваний, либо непосредственно участвуют в патогенезе заболеваний. Показано, что наиболее многообещающими для диагностики ССЗ являются следующие метаболические пути: метаболизм аргинина, цикл мочевины, обмен ацилкарнитинов, метаболизм триптофана.
Для разработки инструментов диагностики, основанных на метаболомном подходе, требуется учитывать множество факторов, таких как специфичность и чувствительность метаболитов, их роль в патогенезе, а также возможные взаимодействия с другими признанными биомаркерами. Успешная интеграция метаболомных исследований в клиническую практику открывает новые горизонты для повышения эффективности профилактики и терапии ССЗ.

.png&w=640&q=75)