В ходе жизни мы сталкиваемся с сотнями и тысячи различных опасностей для нашего здоровья, и подавляющее большинство из них не видно невооруженным глазом. К таким опасностям относятся патогенные представители микроорганизмов, микроскопических грибов, простейшие. Для противодействия им не всегда достаточно одной иммунной системы человека и иногда необходимо вмешательство факторов в лице веществ, не синтезируемых людьми, но получаемых из природы. Одним из таких классов веществ являются фитонциды. А именно, их свойства убивать или подавлять рост и развитие микроорганизмов. В данной работе основной акцент будет сделан на способности фитонцидов подавлять физиологическую активность микроскопических грибов, а именно представителей рода Aspergillus. Такое решение было принято в связи с тем, что эти грибы вызывают широкий спектр заболеваний, известных под общим названием аспергиллезы. Многие из этих болезней приводят к смерти зараженного. Эфирные масла, являющиеся характерными представителями фитонцидов, входят в состав огромного количества различных растений, но в данной работе в приоритете будут фитонциды лука и чеснока в виду их доступности и повсеместности.
Летучие вещества, содержащиеся в эфирном масле растений - фитонциды. Большое количество фитонцидов содержится в луке. Это полезные вещества не только для самих растений, но и для человека.
Целебные свойства лука обусловлены уникальным сочетанием содержащихся в нем веществ. Среди них стоит отметить эфирное масло лука с характерным острым запахом, органические кислоты (лимонная и яблочная); целый ряд витаминов и минералов, в т.ч. кальций, калий, железо, фосфор, йод, сера, селен. Однако высокая эффективность применения лука при самых различных заболеваниях объясняется прежде всего наличием в нем фитонцидов. Они губительно действуют на многие патогенные бактерии, включая возбудителей дизентерии, дифтерии и туберкулеза, золотистый стафилококк и трихомонады.
«Летучие фитонциды высших растений впервые были обнаружены в 1928- 1930 г.г. А.Г. Филатовой и А.Е. Тебякиной. Суть основного открытия состояла в том, что высшие растения при их ранении продуцируют летучие антимикробные вещества. Еще более активным оказался тканевый (клеточный) сок многих растений. Сам термин фитонциды был предложен русским ученым Б. П. Токиным в 1934 году для обозначения летучих веществ, обладающих антимикробными свойствами, которые выделяются растениями. Б. П. Токин обратил внимание на то, что пищевые продукты, приготовленные на восточных базарах, в антисанитарных условиях, не вызывают вспышек инфекционных заболеваний. Ученый предположил, что обилие восточных пряностей каким- то образом предохраняет пищу от порчи. Он исследовал вещества, содержащиеся в пряностях, и обнаружил, что антисептическое действие дают летучие компоненты. Эти «летучие яды растений» он предложил назвать фитонцидами. Есть фитонциды, содержащиеся в тканях растений в растворенном виде, и летучие фракции фитонцидов, выделяемые в атмосферу, почву, воду. Летучие фитонциды способны оказывать свое действие на расстоянии» [1, с. 696].
Все растения выделяют их в целях самозащиты; одни растения выделяют малые количества фитонцидов, другие – в их числе лук и чеснок, – большие. Вопросом о действии фитонцидов на болезнетворных микроорганизмов, возбудителей болезней человека и животных заинтересовались медики и ветеринары. В институте микробиологии и вирусологии имени Д.К. Заболотного АН УССР проблема фитонцидов нашла всестороннее развитие. В 1945 г. при непосредственном участии академика В. Г. Дробатько был получен препарат иманин из растения зверобоя. В 1948 г. этот препарат был внедрен в медицинскую практику и применяется до сих пор при лечении гнойных ран, трофических язв и других заболеваниях.
«При проведении ряда опытов по выявлению действия фитонцидов на морфологию бактериальной клетки было установлено, что под их действием происходит сравнительно быстрое и резко выраженное нарушение таких структур, как клеточная стенка и цитоплазматическая мембрана, некоторые клетки разрушаются даже через 3 часа. Антимикробные свойства фитонцидов обусловили большое число исследований по использованию их в медицине, ветеринарии, защите растений, при хранении плодов и овощей, в пищевой промышленности и др. Расцвет в области изучения фитонцидов приходится на 1950-1980 гг. В эти годы в СССР были проведены обширные исследования антивирусного, противобактериального, иммунтропного и др. эффектов веществ, выделенных из растений при помощи экстракции и др. методов» [2, с. 868].
Выделение Aspergillus из воздуха. Первым шагом собственных исследований было получение нужных плесневых грибов. Зная особенности метаболизма представителей рода Aspergillus и питательные вещества, в которых они нуждаются, мы приступили к подбору оптимальных субстратов для их выращивания. Самым многообещающим из возможных вариантов оказался абрикосовый джем домашнего приготовления. Такой выбор связан со способностью видов рода расти на средах с высоким осмотическим давлением, чем и является вышеупомянутый джем. Таким образом, происходит селективный отбор плесеней, способных усваивать питательные вещества в такой среде, и более того, исключается загрязнение грибковых культур другими микроорганизмами, такими, как бактерии. Тем не менее, для наглядности разницы в культивируемых родах, и даже отделах, мы использовали и другие субстраты, которые можно отнести к типу «наживок». Одним из таких представителей является лимон, который был поперечно разрезан пополам.
Все субстраты были оставлены на 2 ч на воздухе во время ветра, воздушные потоки которого достигали 12 м/с, после чего были обильно увлажнены дистиллированной водой, помещены в термостат при температуре +28°C, являющейся оптимальной для рода Aspergillus, и накрыты пищевой пленкой, но не плотно, т.к. искомые плесени являются облигатными аэробами [3, с. 1268]. На рисунках 1 и 2 представлены результаты жизнедеятельности плесневых грибов на субстратах спустя сутки после помещения образцов в условия культивирования.

Рис. 1. Лимон (1 сутки)

Рис. 2. Абрикосовый джем домашнего приготовления (1 сутки)
По данным изображениям видно, что спустя сутки после двухчасового экспонирования контейнеров на открытом воздухе, получены разные результаты. Лимон на своей поверхности имеет раздельные колонии видные невооруженным глазом, в то время как джем не подвергся визуальным изменениям.
После получения промежуточных результатов, образцы вновь были увлажнены, накрыты пищевой пленкой и помещены в нужную температуру. Спустя двое суток образцы вновь были изучены. На джеме все еще не было заметных изменений, а колонии на лимоне увеличились в размерах и стали соединяться в одну крупную (рисунки 3 и 4).

Рис. 3. Лимон (3 сутки)

Рис. 4. Лимон, крупный план (3 сутки)
Исходя из крупного и стабильного роста плесневых грибов было решено изучить их морфологию, как с помощью макроанализа, так и с помощью микроскопирования приготовленных препаратов. Характеристика колоний представлена в таблице 1.
Таблица 1
Макроскопический анализ плесени на лимоне
|
Признак: |
Характеристика: |
|
Структура мицелия |
Бархатообразные бугорки |
|
Цвет поверхности |
От бирюзового до зеленого в центре, белый по краям |
|
Цвет спор |
Зеленый |
Исходя из данных макроскопического наблюдения и общего хода культивирования плесневых грибов и сопоставления с данными, полученными из справочных пособий, специализирующихся на царстве грибов, мы выяснили, что данная плесень является видом Penicillium digitatum. Так как данный вид является раневым паразитом, то это объясняет тот факт, что плесень отсутствовала на неповрежденном лимоне. Кроме того, данный вид выделяет этилен, ответственный за ускорение созревания плода, и последующее его быстрое высушивание и обезвоживание, которое можно заметить на фото третьего дня. Также данному виду свойственен быстрый рост, что объясняет ранний результат на данном субстрате, который не является характерным для Aspergillus и джема. Данных, полученных с помощью макроскопического наблюдения, хватило для того, чтобы убедиться в том, что несмотря на нужный отдел Аскомицетов, P. digitatum не относится к искомому роду Aspergillus. Данный образец был отсеян и дальнейшим исследованиям не подвергался.
Абрикосовый джем домашнего приготовления продолжал увлажняться, и на 5 сутки была заметна жизнедеятельность микроорганизмов невооружен ным глазом (рисунки 5 и 6).

Рис. 5. Абрикосовый джем домашнего приготовления (5 сутки)

Рис. 6. Крупный план воздушного мицелия неопознанного гриба на абрикосовом джеме домашнего приготовления (5 сутки)
На джеме, выдержанном в течение 5 дней в благоприятных для культивируемого рода условиях, наблюдаются отдельные колонии, обладающие заметным воздушным мицелием белого цвета ватной консистенции. Гифы мицелия заканчиваются плодовыми телами черного цвета.
Спустя 2 дня джем стал еще больше покрываться колониями плесневых грибов (рисунок 7). По прошествии еще 2 суток, поверхность джема была почти полностью закрыта колониями (рисунок 8).
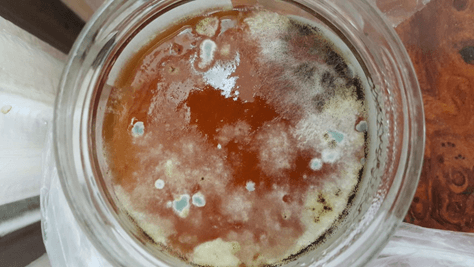
Рис. 7. Абрикосовый джем домашнего приготовления (7 сутки)

Рис. 8. Абрикосовый джем домашнего приготовления (9 сутки)
Девятидневная культура была признана достаточно хорошо развитой на субстрате для создания различных препаратов для микроскопирования, и в тоже время, достаточно молодой для того, чтобы не испытывать чрезмерного
спорообразования.
Первой стадией исследования являлся макроскопический осмотр колоний. Ввиду различающейся морфологии колоний на джеме было отмечено наличие ассоциации плесневых грибов, а не чистой культуры. Сперва были описаны колонии желто-черного цвета по краю контейнера. Их характеристика изложена в таблице 2.
Таблица 2
Макроскопический анализ желто-черной плесени на джеме
|
Признак: |
Характеристика: |
|
Структура мицелия |
Шершавые мельчайшие точки |
|
Цвет поверхности |
Черный |
|
Цвет спор |
Желтый-бледный коричневый |
Вторым объектом исследования был выбран участок, появившийся на пятые сутки, воздушный мицелий которого напоминает вату. Его характеристика представлена в таблице 3.
Таблица 3
Макроскопический анализ плесени, с волокнистым мицелием
|
Признак: |
Характеристика: |
|
Структура мицелия |
Волокнистый |
|
Цвет поверхности |
Белый |
|
Цвет спор |
Коричнево-оранжевый |
Промежуточные результаты указывают, что образцом №1 является представитель рода Aspergillus, а именно Aspergillus niger. Под описание образца №2 подходит вид рода Rhizopus. Для полной уверенности мы провели микрскопирование препарата. Микроскопирование проводилось с помощью техники приготовления культуры на предметном стекле. Для этого была приготовлена среда Чапека, а затем и сами препараты культуры на предметном стекле с помощью скальпеля, препаровальных игл, двух стеклянных палочек, сложенных в форме буквы V, а также фильтровальной бумаги. Полученные препараты инкубировались в термостате в течение 2 суток при температуре +28°C, являющейся оптимальной для обоих предположительных родов.
По прошествии указанного времени чашки Петри с препаратами были извлечены из термостата и рассмотрены (рисунки 9 и 10).
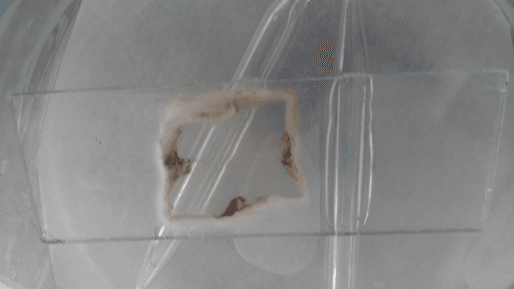
Рис. 9. Культура на предметном стекле образца №1

Рис. 10. Культура на предметном стекле образца №2
Так как плесени показали хороший рост, их препараты были подвергнуты дальнейшим операциям. Мы удалили покровные стекла с блоков агара, а сам блоки был утилизированы. После были взяты новые стерильные предметные стекла, а на них с помощью пипетки Пастера была нанесена капля метиленового синего. Затем покровные стекла, снятые с блоков агара, были помещены на краситель, с целью создания препарата вида раздавленная капля. Непосредственное микроскопирование препаратов проводилось с помощью двух микроскопов – LCD Micro Bresser, снабженного дисплеем и фильтрами различных цветов; Стандартного монокулярного микроскопа.
Микроскопический анализ первого образца подтвердил, что предполагаемая плесень является одним из видов рода Aspergillus. Мицелий плесневого гриба оказался состоящим из септированных гиф, что является превалирующим для всего отдела Аскомицетов (рисунок 11).

Рис. 11. Септированные гифы образца №1
Но что более важно, была обнаружена структура, являющаяся конидией рода Aspergillus (рисунок 12).

Рис. 12. Конидия без конидиеносца образца №1
Более наглядно представлена конидия на фото с оптического монокулярного микроскопа на общем увеличении x400 (рисунок 13).
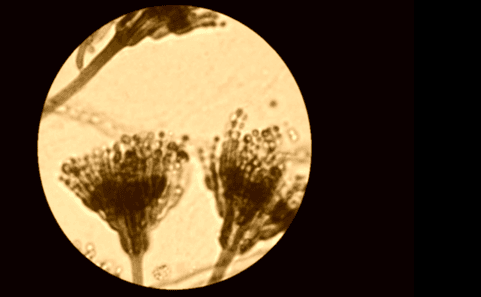
Рис. 13. Конидии на конидиеносцах образца №1
Несмотря на окрашивание образцов метиленовым синим, изображения с препаратов образцов представлены в желтом цвете. Это объясняется использованием специальной лампы в качестве источника света для оптического монокулярного микроскопа вместо зеркала. Данная лампа излучала отчетливо желтый свет. Решение заменить зеркало лампой было принято в силу того, что вся работа по микроскопированию проводилась в боксе, в отсутствие близко расположенных окон.
Препарат образца №2 был приготовлен аналогично образцу №1. Были обнаружены главные морфологические признаки, указывающие на принадлежность образца к роду Rhizopus: ценоцитный мицелий (рисунок 14); спорангий, содержащий внутри множество спорангиеспор (рисунки 15 и 16).

Рис. 14. Участок ценоцитного мицелия образца №2
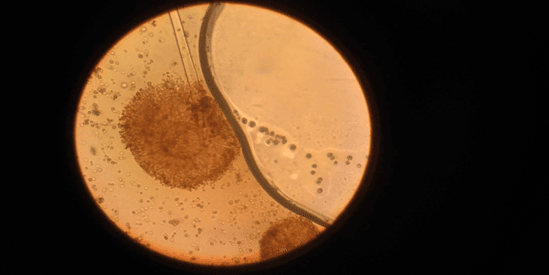
Рис. 15. Спорангий на спорангиеносце образца №2
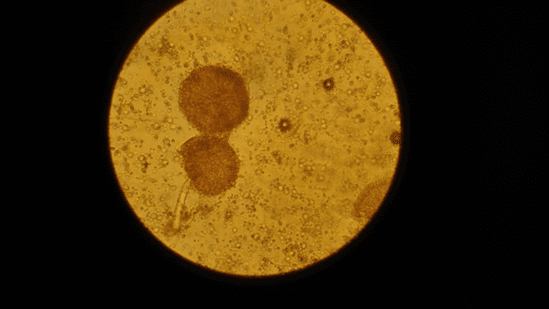
Рис. 16. Спорангии образца №2
Стоит внести ясность и упомянуть, что несмотря на то, что мицелий у Rhizopus несептированный, в нем иногда встречаются участки гиф, напоминающие септы (рисунок 17). Они называются опорными клетками и из них развиваются спорангиеносцы.

Рис. 17. Опорная клетки внутри гифы образца №2
Полученные данные об образцах подтверждают первоначальные идентификации плесневых грибов вплоть до рода [4, с. 736]. В итоге мы имеем желанный род Aspergillus, который и будет переноситься на среду в дальнейшем, а также сторонний род Rhizopus, некоторые виды которого так же могут быть патогенными для человека. Исходя из этого отпадает необходимость получения исключительно культуры Aspergillus. Другим плюсом является то, что температура инкубирования обоих родов идентичная и находится в пределе +26–+30°C. Убедившись в том, что изученные образцы действительно являются представителями родов, необходимых для исследования, мы пересеяли плесневую культуру на среду Чапека и инкубировали в течение недели. Данная культура на чашке Петри будет являться донором в методике ускоренного посева культур микроскопических грибов.
Посев культур Aspergillus на питательные среды и внесение действующих веществ. Эфирные масла были приобретены в аптеке, в то время как фитонциды лука и чеснока были получены в виде соков, взятых из одноименных луковиц. Луковицы были очищены от шелухи, а затем измельчены с помощью пресса для чеснока. После этого, мы выжали мякоть, и её сок был пропущен через ватно-марлевый фильтр. Использовалась та же среда Чапека, что и для приготовления культуры на предметном стекле. Было необходимо приготовить 180 мл среды, из расчета 30 мл на одну чашку Петри. Шестая чашка Петри должна была служить контролем и в нее никакие сторонние вещества не добавлялись. Было внесено по 0,15 мл цитотоксичного вещества на каждую чашку Петри. При таком объеме достигалось концентрация растворенного в среде вещества 0,5%. Среда была изготовлена в объеме 200 мл, т.к. бралась во внимание часть среды, которая выкипит во время приготовления. Непосредственно после готовности среды она была разлита по чашкам Петри. После этого с помощью пипетки мы отмеряли эфирные масла и фитонциды лука и чеснока и добавляли в еще не затвердевшую питательную среду, после чего тщательно перемешивали круговыми движениями чашки по столу. Пипетка промывалась после каждого добавленного вещества.
После затвердевания сред в чашках мы приступили к стадии посева на них культуры. Применяя вышеуказанную методику ускоренного посева, мы смогли справиться с задачей в кратчайшие сроки, после чего поместили все 6 чашек Петри в термостат для инкубирования в течение недели. Первый результат, полученный на третий день инкубирования продемонстрирован на рисунках 18-23.
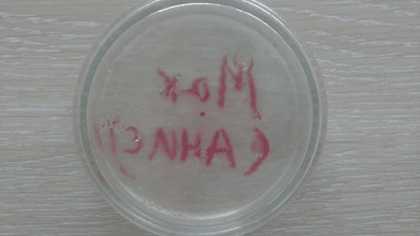
Рис. 18. Среда с добавлением анисового эфирного масла (3 сутки)

Рис. 19. Среда с добавлением коричного эфирного масла (3 сутки)

Рис. 20. Среда с добавлением эвкалиптового эфирного масла (3 сутки)
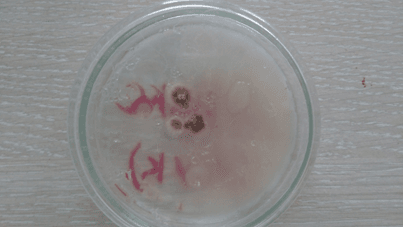
Рис. 21. Среда с добавлением лукового сока (3 сутки)
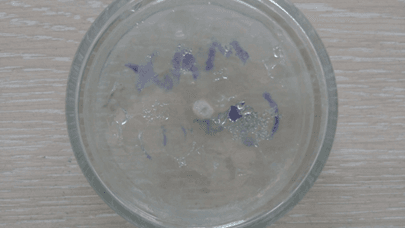
Рис. 22. Среда с добавлением чесночного сока (3 сутки)
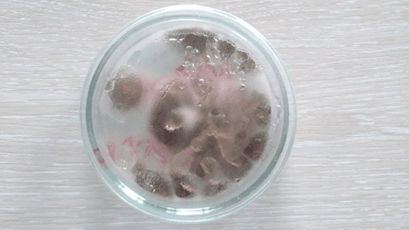
Рис. 23. Среда без добавлений (3 сутки)
На пятые сутки внешний вид культур не претерпел существенных изменений, чего нельзя сказать о сроке в неделю. Семидневный результат представлен на рисунках 24-30.
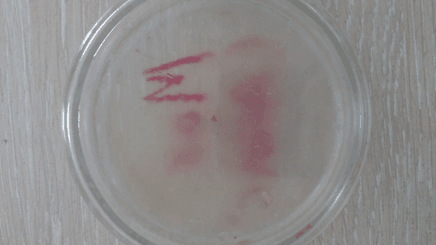
Рис. 24. Среда с добавлением анисового эфирного масла (7 сутки)

Рис. 25. Среда с добавление коричного эфирного масла (7 сутки)

Рис. 26. Среда с добавление эвкалиптового эфирного масла (7 сутки)
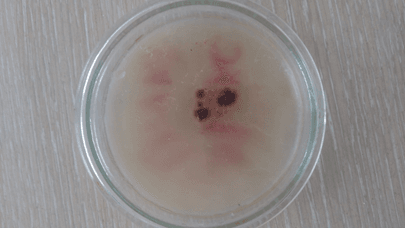
Рис. 27. Среда с добавлением лукового сока (7 сутки)

Рис. 28. Среда с добавлением чесночного сока (7 сутки)

Рис. 29. Среда без добавлений (7 сутки)
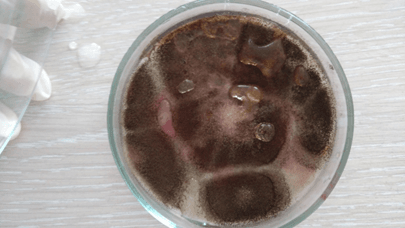
Рис. 30. Среда без добавлений; крышка снята (7 сутки)
На последний день инкубирования двое образцов – анисовое и коричное эфирные масла показали лучший результат, т.к. среды с ними не претерпели изменений. Данные среды выглядели аналогично первому дню, т.е. моменту после непосредственного переноса культуры на среду. Это говорит о высокой степени цитотоксичных свойств и способности полностью остановить спорообразование и развитие грибов, а вместе с тем и производство микотоксинов. Среда с эвкалиптовым эфирным маслом продемонстрировала среднее отклонение от первого результата, что можно интерпретировать как удовлетворительный результат, ведь первые пять дней эфирное масло сдерживало рост Aspergillus, но в итоге уступило анису и корице по своей эффективности. Эффект лука остался без изменений – хорошее подавление роста и спорообразования. Чеснок же на последний день проверки ослабил сдерживание роста плесени до такой степени, что воздушные споры Aspergillus распространились по всей чашке Петри и успешно проросли. Это объясняется слабой степенью очистки по сравнению с эфирными маслами, произведенными в индустриальных условиях. Тем не менее, разница со средой без добавок видна невооруженным глазом, что лишний раз подтверждает наличие у чеснока фунгицидных свойств.
Подводя итоги всего исследования, можно с уверенностью сказать, что эфирные масла показывают сильный цитотоксичный эффект уже на первые сутки инкубирования, в то время как питательная среда без добавлений не сдерживает как-либо рост микроскопических грибов. Что касается соков, полученных из лука и чеснока, то очевидно, что данные субстанции обладают свойствами, задерживающими и подавляющими рост таких грибов, но в данном эксперименте менее выраженными, чем у эфирных масел. Это связано со слабой степенью очистки и концентрирования соков, а также высоким содержанием посторонних веществ (крупнодисперсные частицы сока) по сравнению с действующими веществами соков – метил метантеосульфинат и 10-диалкенилтиосульфинат. Причиной тому служит примитивный способ получения таких соков - прессование и последующее пропускание полученной жидкости через ватно-марлевый фильтр. В промышленных же условиях они проходят несколько последовательных ступеней, чаще всего включающих какой-либо подвид экстракции и фракционированную конденсацию либо гель-фильтрацию в тандеме с ионно-обменной хроматографией [5, с. 490]. Тем не менее, даже с несопоставимым эффектом эфирных масел, очевидны свойства лука и чеснока замедлять рост и развитие микроскопических грибов даже в мельчайших дозах, будучи не очищенными, что приравнивается к их состоянию на момент употребления в пищу. Все это повышает ценность лука и чеснока для человека, в частности их профилактическую значимость не только в качестве пищи, но и при ингаляции их соков. Кроме того, данные растения могут применять в приготовлении домашних варений и солений – небольшое количество лукового или чесночного соков, внесенное перед консервированием, может послужить превентивной мерой для развития нежелательной микрофлоры. Последним, но не по значимости, является низкая стоимость съедобных представителей рода Allium по сравнению с товарными формами эфирных масел.

.png&w=640&q=75)