Одним из удобных способов функционализации производных имидазо-[2,1-b][1,3,4]тиадиазолов, с целю повышение их биологической активности, является реакции электрофильного и нуклеофильного замещении.
Слияние с имидазольным кольцом 1,3,4-тиадиазолового ядра порождает класс гетероциклических систем, содержащих атом азота, как плацдарм (мостик) и образующих два типа конденсированного гетероцикла: имидазо[2,1-b][1,3,4]- тиадиазол (1) и имидазо[5,1-b][1,3,4]тиадиазол (2) [1].
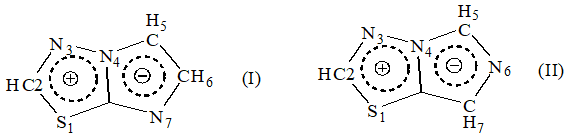
Обе системы содержат атом азота в качестве мостика на 4-й позиции. В данной работе обсуждается только бициклический имидазо[2,1-b][1,3,4]-тиадиазол. Эти резонансные структуры указывают на более высокую делокализацию π-электронов в имидазольном кольце, в то время, как двойная связь тиадиазольного кольца почти локализована. Структура I является максимально реакционноспособной.
Имидазо[2,1-b][1,3,4]тиадиазольное кольцо ведёт себя, как псевдоароматическая система, содержащая фрагмент имидазола, как электронбогатый центр, и представляет собой бициклическую ароматическую систему. Известно, что положение 5 в имидазо[2,1-b][1,3,4]тиадиазольном бицикле является местом повышенной электронной плотности. Хлор или бром не присоединяются к двойной связи во 2-ом и 3-ем положении. С другой стороны, реакции электрофильного замещения происходят на 5-ом положении, а нуклеофильного замещения во 2-ом положении гетероцикла. Поэтому избыточная электронная плотность сосредоточивается в имидазольном фрагменте и увеличивая его 5-СН-кислотностности, а в тиадиазольном фрагменте уменьшает плотность электронов и приобретает способности тиадиазольном фрагменте к нуклеофильному замещении [2, с. 275; 2, с. 7].
Вышеуказанная структура можно подтвердить поведение 1 с молекулярным бромом, который ранее нами сообщено в работе [3, с. 817-820] и настоящей исследуемый работ, который посвящено тиоцианироавиния соединения 1 в присутствии молекулярного брома в среде уксусной кислоты, а также изучение ИК- и ЯМР 1Н и 13С спектральной характеристики соединения 2. Механизм реакция тиоцианирования 1 проведено по следующей схеме:
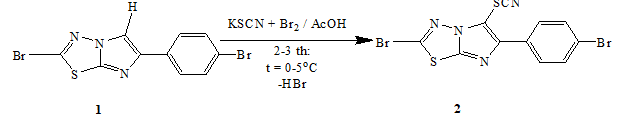
Схема
Реакция тиоцианирование 1, как было упомянуто выше (схема), протекает по механизме электрофильной замещении при 0-5оС с хорошим выходом 70%. Полученное соединения представляют собой белый кристаллический вещества, хорошо растворяется в этаноле, изопропанола, диоксана, ДМФА и ДМСО. Структура 2 установлено методом ИК- и ЯМР 1Н и 13С спектрометрии, а индивидуальность и ход реакции контролировано методом тонкослойной хроматографией в системе диэтиловый эфир-этанола при соотношении 3:1. Пятно обнаружено в йодной камере.
Другой подход к формированию производных имидазо[2,1-b][1,3,4]-тиадиазолов заключается во взаимодействии соединения 1 c роданидом калия в среде изопропанола при нагревании в течение 2 ч. Данный подход позволяет получить 2-тиоциано-6-(4-бромфенил)имидазо[2,1-b][1,3,4]-тиадиазол 3, что можно использовать как ключевой соединения для синтеза серии производных имидазо-тиадиазолов.
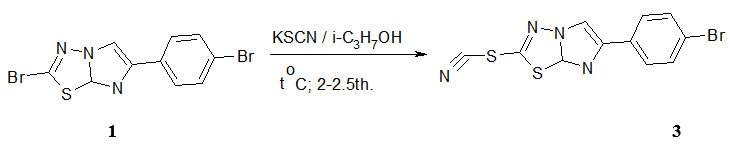
О ИК-спектре соединения 1 ранее мы сообщали в [3, С. 818]. В настоящей работе дополнительно изучена частотная зависимость интегральной интенсивности линий валентных колебаний СН замещенных ароматических групп. Таким образом, в зависимости от количества атомов водорода, обнаружены плоские деформационные колебания в областях 1125, 1077 и 939 см-1, и неплоских деформационных колебаний в области ниже 838 и 721 см-1. Также, для Саром.=Саром. в области полосы средней интенсивности 1631-1505 см-1 обнаружено обертонное валентное колебание п-бромфенила, что свидетельствует о положении заместителей в бензольном кольце [4, с. 168; 5, с. 237; 6, с. 38].
Далее, опираясь на литературные данные [7] и учитывая расположения углеродов в 2-бром-6-(4-бромфенил)имидозо[2,1-b][1,3,4]тиадиазола (1), 2-бром-5-тиоциано-6-(4-бромфенил)имидазо[2,1-b][1,3,4]-тиадиазола (2) и 2-тиоциано-6-(4-бромфенил)имидазо[2,1-b][1,3,4]-тиадиазол (3) нами изучены структуры полученных соединении методом 13С ядерного магнитного резонанса. Для начала были пронумерованы все атомы исходного соединения.
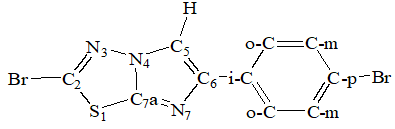
B спектре ЯМР 13C сигналы углеродов в 2-бром-6-(4-бромфенил)имидозо[2,1-b][1,3,4]-тиадиазола у С-2, С-5, С-6, С-7а и С-о-, м- и п- замещенной фенильной группы наблюдаются в области 159.74 м.д. (С-2), 109.44 м.д. (С-5), 145.05 (С-6), 146.01 (С-7a), 133.05 (С-i), 121.35 (С-p), 131.94 м.д. (С-m), 126.64 м.д. (С-o).
В ИК-спектре соединения 2 в кристаллическом состояние характерные полосы поглощении гетероцикла проявлено в области 1595 и 1531 см-1 для С=N – тиадиазольно-имидазольного фрагмента, а для С=С – имидазольного фрагмента полоса поглощении обнаружено в области 1473 см-1. Полоса поглощения в области 722 см-1 характерно для С-Br - тиадиазольного фрагмента. Полоса поглощения C-S-C – тиадиазольного фрагмента обнаружено в области 680 см-1. Характерная полоса поглощения в области 1191 см-1 относящейся к С-N-между имидазо-тиадиазольной фрагменты данного гетероцикла проявлено в слабом интенсивном поле. Для п-бромфенильного фрагмента в соединения 2 наблюдают полоса поглощения деформационных колебаний СН бензольного кольца при 737 см-1 и полоса поглощение валентной колебании δС.-Нар в области «отпечаток пальцы» при 1054 и 1095 см-1. Для тиоциановая группа полоса поглощения обнаружено в области 2065 см-1.
У соединения 3 характерные полосы поглощения гетероцикла проявлены в области 1685 и 1586 см-1 для С=N-тиадиазольно-имидазольного фрагмента, а для С=С - имидазольного фрагмента полоса поглощения обнаружена в области 1472 см-1. Полоса поглощения в области 2068 см-1 характерна для 2-SСN-тиадиазольного фрагмента. Полоса поглощения C-S-C-тиадиазольного фрагмента обнаружена в области 683 см-1. Для п-бромфенильного фрагмента в соединении 3 наблюдается полоса поглощения валентных колебаний в области 3145 см-1, полоса поглощения плоских деформационных колебаний СН бензольного кольца в области 1167-959 см-1, а полоса поглощения неплоских деформационных колебаний замещенного бензольного кольца проявлена в области ниже 900 см-1, т.е. при 934-828 см-1. Также полоса поглощения валентных колебаний δС.-Нар проявлена в области «отпечатков пальцев» 1020 и 1071 см-1.
По сравнению с исходным продуктом - 2-бром-6-(4-бромфенил)имидазо-[2,1-b][1,3,4]-тиадиазола (1), при замене водорода 5-го положения имидазольного фрагмента и брома 2-го положения на тиоциановую группу в ИК-спектре соединений 2–3 полосы поглощении валентной и деформационной колебании наблюдается в сильном интенсивном поле.
Продукт так же охарактеризован с помощью данных 1H- и 13С ЯМР- спектральных исследований, а также данными элементного анализа. B 1H ЯМР спектре соединения 2 обнаруживаются 4 сигналы СH-протонов в виде сильно уширенных, в области δ 1H NMR (400 MHz, СDСl3) δ, 7.68 (m, 2H-o), 7.53 м. д. (s, 2H-m), что указывает на наличие п-бромфенильной группы. В 1Н ЯМР-спектре 3 сигнал протонов обнаружен при δ 7.93 (s, 1H, С(5)-Н), 7.67 (s, 2H-о), 7.52 (s, 2H-m).
В 13С ЯМР спектре соединения 2 химсдвиги атомов углерода по сравнению с соединением 1 проявлены в некоторых пиках в сильном поле. Так, сигнал атома углерода С-2-тиадиазольного фрагмента по сравнению с соединением 2 проявляется в области слабого поля 160.06 м. д. Атом углерода, находящийся в пятом положении цикла, проявляется в области 109.92 м.д. (С-5), соответственно. А сигнал атома углерода тиоциановым фрагментом проявляется в более слабом поле, т.е. в 121.80 м. д. Атом углерода в шестом положении имидазольного фрагмента, проявляется в области 133.14 м.д., а атом углерода С-7а, проявляется в области 146.21 м. д. В спектре 13С ЯМР соединений 3 сигналы углеродов относительно С-2 и С-5 имдазотиадиазольного фрагменты несколько смешиваются в области слабых полей по сравнению 1 и проявляются соответственно при δ = 159.70, 109.59.
Таким образом, применение вышеизложенных методов ИК-, 1Н- и 13С-спектроскопии для соединении 1–3 убедительно подтверждается их строение, представленное в таблице 1. Это позволило использовать данное соединения в качестве исходного для синтеза серии производных 6-(4-бромфенил)имидазо[2,1-b][1,3,4]тиадиазола.
Благодарность
Авторы выражают глубокую благодарность д.х.н., профессору Мухидинову З.К. за оказание помощи при выполнении спектральных исследований.

.png&w=640&q=75)