Значительно возросшая потребность в оптических отбеливающих веществах (ООВ) продиктована широким использованием их при производстве белых красок, пластических масс, для отбеливания натуральных волокон и других материалов. Среди ООВ важное место занимают производные бистриазиниламиностильбенов (торговое название - белофоры). Белофоры используются при отбеливании бумаги, целлюлозных волокон, а также в производстве синтетических моющих средств и в бытовой химии.
К качественным показателям ООВ - содержание целевого вещества, дисперсность, чистота, цветность, термо- и светостойкость - предъявляются высокие требования. Определяющее влияние на уровень этих показателей оказывает качество полупродуктов используемых при производстве ООВ.
4,4’-динитростильбен-2,2’-дисульфокислота (ДНС – С14Н10O6NS) является одним из полупродуктов в производстве белофоров. Ее получение осуществляется синтезом из 4 - нитротолуола (ПНТ) или пара-нитротолуол-орто-сульфокислоты (ПНТСК; 4-нитротолуол-2-сульфокислоты – С7Н7O6NS). Однако низкий выход на стадии синтеза (65-68 %) приводит к перерасходу сырья и соответственно к удорожанию продукта. Кроме того, процесс окисления при производстве ДНС стабилен в ограниченном интервале температур (57-60 °С), что осложняет его проведение. Незначительные отклонения от технологического режима - увеличение температуры, щелочности реакционной массы, недостаток кислорода, изменение порядка загрузок - приводят к образованию, наряду с ДНС, азокрасителей оранжевого и красного цвета, наличие которых (до 1-1,5 %) снижает у ДНС показатели чистоты (поглощение света в ультрафиолетовой области) и цветности (поглощение света в видимой области).
Одним из побочных веществ уменьшающих коэффициент экстинкции при производстве ДНС-кислоты является 4,4'-диметилазобензол-3,3'-дисульфокислота (ДМАБ - С14Н14O4NS). Образование этого вещества идет параллельно с наработкой целевого продукта (ДНС).
Чтобы снизить скорость процесса образования красителя, реакционная смесь должна содержать избыток кислорода. Химическая реакция окислительной димеризации ПНТСК протекает в жидкой фазе (растворе), поэтому для насыщения реакционной массы кислородом используют различное оборудование.
Традиционная схема производства ДНС-кислоты представляет собой последовательность следующих технологических операций: подготовка сырья → химический синтез → выделение в виде водной суспензии → фильтрация. Сырьем для получения ДНС является 4 - нитротолуол - 2 - сульфокислота. На стадии химического синтеза параллельно с основной реакцией возможно протекание и побочных реакций, в результате которых образуются вещества красного цвета. Для определения химического состава побочных веществ необходимо рассмотреть механизм химического процесса окислительной димеризации ПНТСК. Получение целевого продукта ДНС-кислоты протекает ступенчато, с образованием промежуточного вещества 4,4’-динитробензил-2,2’-дисульфокислоты (ДНДБ, С14H12O6NS).
Реакционная способность ПНТСК в реакции окислительной димеризации определяется подвижностью атомов водорода в метильной группе, которая зависит от следующих факторов:
- положения и природы уже имеющихся заместителей;
- природы действующего агента;
- условий проведения реакции.
Решающее значение имеют два первых фактора [1-3].
Заместители в бензольном кольце можно разделить на две группы. Заместители первого рода - это группировки атомов способные отдавать электроны (электронодонорные). К ним относятся OH, OR, OCOR, SH, SR, NH2, NHR, NR2, NHCOR, CH3, F, Cl, Br, I [1-3].
Заместители второго рода - это атомные группировки, способные притягивать электроны от бензольного ядра (электроноакцепторные). К ним относятся SO3H, NO2, CHO, COR, COOH и т.д. [1-3].
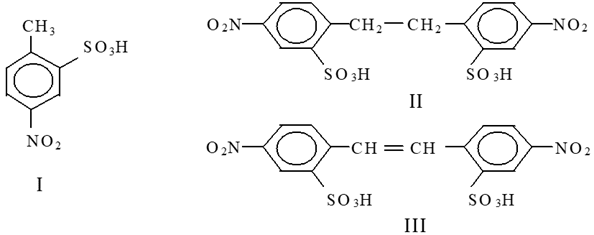
Рис. Структурные формулы молекул: ПНТСК (I), ДНДБ (II) и ДНС (III)
На рисунке представлены структурные формулы молекул ПНТСК (I), ДНДБ (II) и ДНС (III). Молекула ПНТСК в положениях 2 и 4 имеет две электроноакцепторных группировки - SO3H и - NO2, которые притягивают p-электроны бензольного кольца, что вызывает смещение электронов s-связей метильной группы.
Это приводит к поляризации CH связей и способствует отрыву протона метильной группы. Необходимо отметить, что степень окисления атома углерода метильной группы равна -3 [4].
Каждый фрагмент молекула ДНДБ в положениях 2 и 4 имеет две электроноакцепторных группировки - SO3H и - NO2, которые притягивают p-электроны бензольного кольца, что вызывает смещение электронов s-связей метиленовой группы. Однако, степень окисления атома углерода метиленовой группы равняется -2, и по этой причине ДНДБ является более слабым восстановителем чем ПНТСК [4].
Отмеченные различия в восстановительных свойствах атомов углерода метильной (ПНТСК) и метиленовой (ДНДБ) групп, необходимо учитывать при разработке технологических условий производства ДНС.
Молекула ДНС отличается от ПНТСК и ДНДБ наличием этиленовой группы. Вследствие этого она имеет копланарную структуру и способна к цис-, транс-изомерии [1-3]. Атом углерода у молекулы ДНС находится в состоянии sp2-гибридизации и имеет степень окисления -1 [4]. Согласно степеням окисления атомов углерода метильной, метиленовой и этиленовой групп, по устойчивости к действию окислителей ПНТСК, ДНДБ и ДНС можно расположить в следующий ряд:
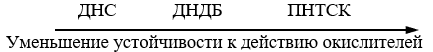
Для корректной оценки характера протекания процесса очень важно выбрать объективный метод анализа концентраций исходного и конечного веществ в реакционной массе. Для этой цели наиболее подходящим является спектрофотометрический метод анализа. Он удобен в связи с тем, что ПНТСК и ДНС поглощают в различных областях ультрафиолетового (УФ) спектра - при λмах=275 нм и λмах=350 нм соответственно.
Схематически метод синтеза 4,4’-динитростильбен-2,2’-дисульфокислоты (ДНС) представляют в следующем виде [5]:
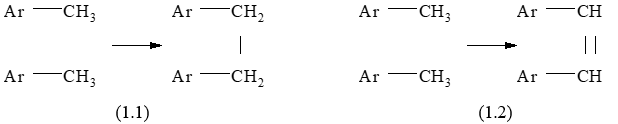
При окислении боковой метильной (- СН3) группы 4-нитротолуола или 4-нитро-2-сульфокислоты толуола происходит образование производных дифенилэтана (1.1) или дифенилэтилена (1.2). В зависимости от выбора исходного сырья (ПНТ или ПНТСК) промышленные способы получения ДНС-кислоты различаются параметрами технологического режима (используемый окислитель, катализатор, растворитель и т.д.) и аппаратурным оформлением стадии химического синтеза.
Для обеих реакций в качестве окислителя применяют гипохлорит натрия (NaClO), перекись натрия (Na2O2), персульфат аммония ((NH4)2S2O8), перекись свинца, а также можно проводить электрохимическое окисление в щелочной среде [3]. Однако наиболее дешевым и более распространенным окислителем в этом процессе служит кислород воздуха.
Промышленное распространение получили следующие способы синтеза ДНС:
- окислительная димеризация 4-нитротолуола в 4,4’-динитростильбен-2,2’-дисульфокислоту;
- окислительная димеризация 4-нитротолуол-2-сульфокислоты в 4,4’-динитростильбен-2,2’-дисульфокислоту в присутствии гипохлорита натрия;
- окислительная димеризация 4-нитротолуол-2-сульфокислоты в 4,4’-динитростильбен-2,2’-дисульфокислоту в присутствии кислорода воздуха.
Предложен способ [6] получения ДНС (III) из 4 - нитротолуола (IV). Процесс осуществляется обработкой ПНТ 3 частями дымящейся серной кислоты, содержащей 25 % SO3 (олеум), при температуре 110 °С. В этом случае, одновременно с окислительной димеризацией протекает процесс сульфирования, и синтез завершается образованием ДНС. Реакция представлена схемой (1.3).
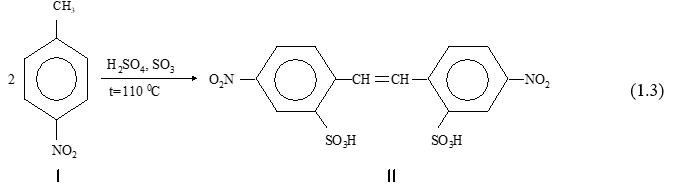
Проведение стадий сульфирования и окисления в одном аппарате позволяет существенно уменьшить время проведения процесса, и одновременно сократить расходы, связанные с транспортировкой и хранением реагентов.
Следует отметить, что предложенный способ проводится при температуре 110 °С, однако, при повышении температуры реакционной массы выше 80 °С возрастает скорость побочных реакций [7].
Процесс окисления 4-нитротолуол-2-сульфокислоты (I) в 4,4’-динитростильбен-2,2’-дисульфокислоту (III) проводят гипохлоритом натрия в водном растворе щелочи [8, 9]. Содержание натриевой соли ПНТСК в реакционной массе составляло 70-75 кг/м3. Концентрацию щелочи в реакторе поддерживали в пределах 2-2,2 %. В реакционную массу при температуре 80-85 °С постепенно придавали водный раствор гипохлорита натрия (концентрация 140 кг/м3), выдерживая соотношение гипохлорит натрия/реакционная масса - 10/364. Реакция представлена схемой (1.4):
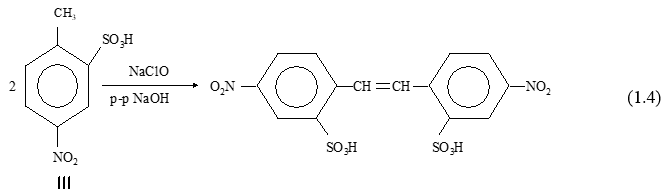
По окончании реакции смесь охлаждали до 8 °С и фильтровали. Выход целевого вещества составил 64-66 %.
Предложенный способ позволяет получить ДНС с меньшим содержанием побочных продуктов по сравнению со способом [6].
Наибольшее распространение в промышленности получил способ окисления 4-нитротолуол-2-сульфокислоты кислородом воздуха в присутствии катализаторов - металлов переменной валентности [10, 11]. Реакция синтеза ДНС представлена схемой (1.5).
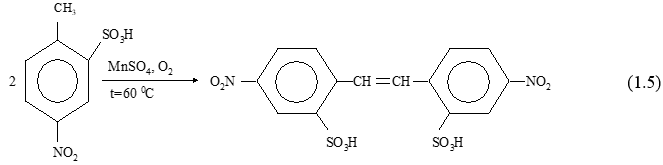
Процесс окисления 4-нитротолуол-2-сульфокислоты (I) в 4,4’-динитростильбен-2,2’-дисульфокислоту (III) проводили в водном растворе щелочи.
Выход целевого продукта в пересчете на ПНТСК составлял 67-71 %.
Этот метод получил наибольшее распространение в промышленности вследствие дешевизны окисляющего агента (кислорода воздуха) и простоты схемы производства.
Однако, рассматриваемый процесс осложнен протеканием, наряду с основной, ряда параллельных реакций образования веществ оранжево-красного цвета, что снижает флуоресцентных свойств отбеливателей, для получения которых ДНС является полупродуктом.
Выводы
Из всех рассматриваемых способов получения 4,4’-динитростильбен-2-дисульфокислоты предпочтение следует отдать способу с использованием в качестве окислителя кислорода воздуха, который при достаточно высоком выходе целевого продукта обеспечивает качественные характеристики продукта и экологическую безопасность производства.

.png&w=640&q=75)