В связи с тем, что процесс окислительной димеризации с использованием в качестве окислителя - кислорода воздуха получил наибольшее распространение в промышленности, для наработки ДНС в качестве катализатора было предложено использовать сульфат марганца [1-3].
В предложенном способе использовали жесткий температурный режим, что не позволило существенно увеличить выход конечного продукта.
Авторы работы [15] предложили использовать в качестве катализатора нитрат марганца и выделять образовавшийся продукт из реакционной массы с помощью кристаллизации при t=20 °С. Использование катализатора нитрата марганца позволило снизить показатель цветности ДНС с 30 до 28 единиц. Выход с операции в этом случае составил 66-67 %.
При использовании нитрата марганца не удалось достигнуть значительного повышения качества ДНС, кроме того при такой температуре сильно возрастает вязкость фильтрата, что приводит к закупорке пор фильтрующего материала и остановке процесса.
Влияние различных металлов на процесс окислительной димеризации ПНТСК исследовалось при использовании композиции из сульфатов марганца, молибдена, ванадия, железа и кобальта.
Предлагается рассмотреть в качестве катализатора окисления ПНТСК сульфат марганца (II) [4-6]. Электронное строение соединений марганца (II) представляет большой интерес, т.к. имеет наполовину заполненную d-орбиталь. На рисунке 3.1 приведен спектр иона [Mn(H2O)6]2+ в видимой области. Mn2+ в октаэдрическом окружении с другими лигандами имеет аналогичные спектры [57].
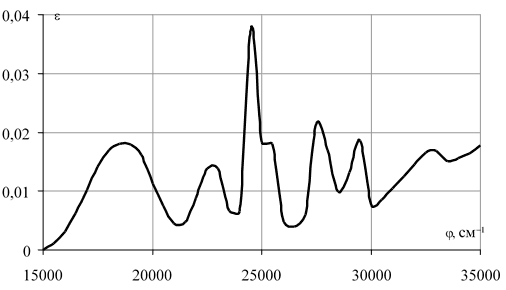
Рис. 1. Спектр иона [Mn(H2O)6]2+ в видимой области
Приведенный спектр характеризуется малой интенсивностью полос поглощения.
Малая интенсивность обусловливает слабую окраску иона [Mn(H2O)6]2+. Многие соли и комплексные соединения Mn2+, в которых ион находится в октаэдрическом окружении также имеют бледно-розовый цвет, а мелко раздробленные вещества даже кажутся белыми. Причины малой интенсивности линии поглощения заключается в следующем. В основном состоянии система d5, находящаяся в слабом октаэдрическом поле, имеет на каждой d-орбитали по одному электрону, спины, которых параллельны, т.е. система представляет собой спиновый секстет. Это соответствует основному состоянию свободного иона 6S, которое не расщепляется в поле лигандов. Это секстетное состояние является единственно возможным, т.к. всякая перестановка электронов в системе t32g e2g приводит к спариванию двух или четырех электронов, превращая это состояние в квартетное или дублетное. Следовательно, все возбужденные состояния системы d5 имеют спиновую мультиплетность, отличную от мультиплетности основного состояния, и переходы между ними запрещены по спину. Вследствие слабого спин-орбитального взаимодействия такие переходы все же происходят, но соответствующие им полосы поглощения имеют очень малую интенсивность. Рассмотрение электронной конфигурации иона Mn2+ необходимо в связи с тем, что именно она определяет его окислительно-восстановительные свойства. Известно, что полностью или наполовину заполненные орбитали имеют повышенную стабильность по сравнению с не полностью заполненными орбиталями [7].
В качестве объектов исследования были выбраны сульфаты Mn2+, Fe2+, Co2+, Ni2+, Cu2+ (в возбужденном состоянии), имеющие на d-орбиталях 5, 6, 7, 8 и 9 электронов соответственно.
Влияние катализаторов на процесс окислительной димеризации ПНТСК изучали на установке, представленной на рисунке 2, которая состоит из емкости 1, погруженной в термостат 2. Нагрев осуществляли кипятильником 3. Для перемешивания реакционной массы предусмотрена лопастная мешалка 4. Воздух подавали через барботер 5, встроенный в нижнюю часть реактора. Расход воздуха контролировали ротаметром (РТ-1). Измерение и регулирование температуры осуществляли термопарой и прибором ТР-200 6.
Эксперимент проводили следующим образом: в емкость последовательно загружали воду (1100 мл); мыло (0,2 г); катализатор (0,08 г); пеногаситель (трибутилофосфат, 0,6 мл); щелочь (NaOH, 150 мл, концентрация 45 %). При включенной мешалке через барботер подавали воздух (Q=0,6 м3/ч). Заливали гомораствор ПНТСК (280 мл, плотность 1,186 г/см3, кислотность 179 г/л, концентрация 298,5 г/л). Щелочность реакционной массы доводили до 2 % путем добавления NaOH по 2 - 5 мл.
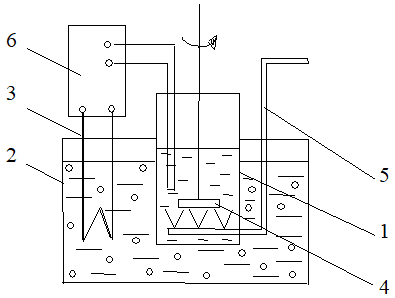
1 – емкость; 2 – термостат; 3 – кипятильник; 4 – мешалка; 5 – барботер; 6 – прибор ТР-200
Рис. 2. Экспериментальная установка
Процесс окислительной димеризации ПНТСК проводили при температуре 52 °С. Продолжительность процесса 12 часов. Частота вращения мешалки во всех опытах 500 об/мин. С интервалом в 1 час отбирались пробы реакционной массы. Определялась концентрация ПНТСК и рассчитывалась степень превращения исходного компонента.
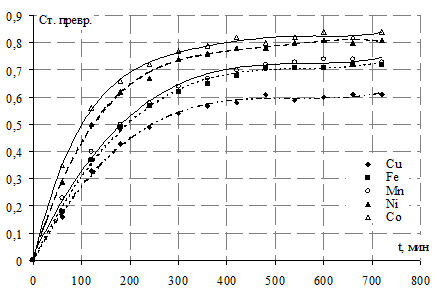
Рис. 3. Исследование влияния каталитических свойств металлов переменной валентности на процесс окислительной димеризации ПНТСК
По результатам экспериментальных исследований построены графические зависимости, представленные на рисунке 3.
Как следует из данных рисунка 3, по эффективности действия исследованные катализаторы можно расположить в следующий ряд
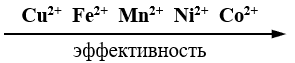
Необходимо учесть, что все катализаторы кроме Cu2+ находятся в восстановленной форме. Если принять, что их каталитическое действие проявляется после реакции с кислородом воздуха в виде Ме3+, то полученную зависимость можно объяснить следующим образом. У Mn2+ стабилизирована восстановленная форма, а у Fe2+ - окисленная. У Co2+ и Ni2+ восстановленная и окисленная формы не стабилизированы. Именно этой причиной объясняется их повышенная эффективность. Следует учесть, что вышесказанное относится к октаэдрическим аквакомплексам типа [Mе(H2O)6]2+ или [Mе(H2O)6]3+, которые автор [2] считает свободными ионами. Он же отмечает, что в случае комплексообразования может произойти стабилизация восстановленной или окисленной формы, что приводит к полному изменению окислительно-восстановительных свойств катализатора.
Эффективность действия комплексных соединений, содержащих различные лиганды, в качестве катализаторов процесса окислительной димеризации ПНТСК изучали на установке, представленной на рис.2.
В качестве объектов исследования использовали бензоаты Mn и Ni, оксалаты Mn и Ni, и малеаты Mn и Ni. В контрольном эксперименте в качестве катализатора использовали сульфаты Mn и Ni.
Обработанные экспериментальные данные представлены на рисунке 4.
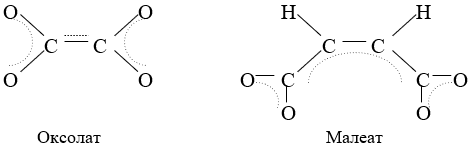
Рис. 4. Исследование эффективности действия комплексных соединений, содержащих различные лиганды, в качестве катализаторов процесса окислительной димеризации ПНТСК
Как следует из рисунка 4, бензоаты Mn и Ni уступают по эффективности сульфату марганца. Оксалаты и малеаты Mn и Ni его превосходят. Это объясняется тем, что два иона (оксолат и малеат) представляют протяженную непрерывную систему сопряженных p-связей между ионами металлов, что способствует увеличению скорости электронного обмена в окислительно-восстановительных процессах.
Низкая эффективность бензоатов Mn и Ni объясняется тем, что бензольное кольцо в данном случае проявляет свойство акцептора электронов. Это отразилось на скорости электронного обмена в процессе окислительной димеризации ПНТСК и привело к снижению выхода ДНС. Следует отметить, что основные закономерности электронного обмена в окислительно-восстановительных процессах, описанные в [8], проявились и в случае окислительной димеризации ПНТСК.
Выводы
Исследовано влияние солей металлов переменной валентности на процесс окислительной димеризации ПНТСК. Установлено, что наибольшей активностью, а следовательно и каталитическими свойствами, обладают соли кобальта и никеля.
Исследована эффективность действия различных лигандов комплексных соединений в качестве катализаторов процесса окислительной димеризации ПНТСК. Установлено, что оксолаты и малеаты металлов переменной валентности значительно ускоряют процесс окислительной димеризации ПНТСК по сравнению с сульфатами и бензоатами тех же металлов.

.png&w=640&q=75)