Ввиду того, что в действительности сложные реакции состоят из ряда простых реакций, причем обнаружить образующиеся промежуточные вещества очень трудно (а иногда просто невозможно), поэтому, будем рассматривать скорость протекания сложной реакции окислительной димеризации ПНТСК в ДНС, наблюдая только исходные реагенты и конечные продукты.
Процесс окислительной димеризации ПНТСК в ДНС можно представить в следующем виде:
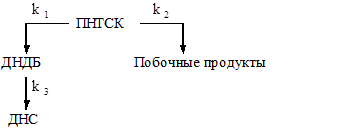
Процесс проводим в реакторе периодического действия емкостного типа, т.к. при проведении процесса окисления непрерывным способом за счет получения большого количества побочных продуктов снижается выход целевого вещества. Процесс окислительной димеризации ПНТСК может осуществляться по двум направлениям:
- с образованием промежуточного соединения ДНДБ (III);
- с образованием побочного продукта - 4,4'-диметилазобензол-3,3'-дисульфокислота (ДМАБ) (V).
Далее ДНДБ (III) реагирует и получается ДНС.
Реакция дегидрирования ПНТСК в ДНС-кислоту является реакцией первого порядка. Скорости изменения концентрации ПНТСК, ДНДБ и азокрасителя в течении процесса окисления можно представить в следующем виде:
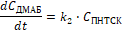 (1)
(1)
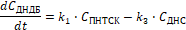 (2)
(2)
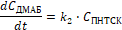 (3)
(3)
Однако ДНДБ расходуется на образование ДНС, поэтому:
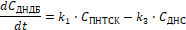 (4)
(4)
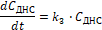 (5)
(5)
где CПНТСК - концентрация ПНТСК, г×л –1;
CДНС - концентрация ДНС, г×л –1;
CДНДБ - концентрация ДНДБ, г×л –1;
СДМАБ - концентрация побочного продукта, г×л –1;
k1 - константа скорости реакции ПНТСК®ДНДБ, с –1;
k2 - константа скорости реакции ПНТСК®ДМАБ, с –1;
k3 - константа скорости реакции ДНДБ®ДНС, с –1.
Константу скорости химической реакции можно определить только экспериментально.
Константа скорости химической реакции является величиной постоянной при постоянной температуре, однако авторами [2] предлагается вести процесс окислительной димеризации ПНТСК при нагревании реакционной массы со скоростью 2-2,5 град/час в течении 6-8 часов. Такой режим нагрева позволяет снизить количество побочного продукта, образующегося на первой стадии процесса ПНТСК→ДМАБ. Вероятно, энергия активации E2 реакции ПНТСК→ДМАБ больше энергии активации E1 параллельной реакции ПНТСК→ДНДБ. На второй стадии, где побочные продукты не образуются, повышение температуры влияет на увеличение скорости превращения ДНДБ→ДНС.
Окислителем при дегидрировании ПНТСК в ДНС является кислород воздуха. Побочным продуктом, согласно механизму реакции окислительной димеризации ПНТСК предложенному в пункте 2.1 является азокраситель - 4,4'-диметилазобензол-3,3'-дисульфокислота. Недостаток окислителя в реакционной смеси приводит к увеличению количества побочных продуктов [20], что ведет к снижению качества целевого вещества. Интенсифицировать процесс насыщения реакционной среды кислородом можно выбрав оптимальный метод и конструкцию аэратора.
При оценке эффективности различных конструкций аэраторов руководствуются двухпленочной теорией массообмена. Кинетическое уравнение процесса растворения кислорода имеет вид:
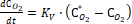 , (6)
, (6)
где KV - объемный коэффициент массопередачи, с –1;
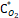 - равновесная концентрация кислорода в реакционной смеси, кг×м –3;
- равновесная концентрация кислорода в реакционной смеси, кг×м –3;
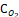 - текущая концентрация растворенного в жидкости кислорода, кг×м –3.
- текущая концентрация растворенного в жидкости кислорода, кг×м –3.
Для определения объемного коэффициента массопередачи кислорода KV необходимо знать концентрацию растворенного в реакционной массе кислорода, которое определяется экспериментально. Однако, определение величины 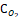 непосредственно в реакторе осложнено побочной реакцией, в ходе которой выделившийся кислород также растворяется в массе.
непосредственно в реакторе осложнено побочной реакцией, в ходе которой выделившийся кислород также растворяется в массе.
Так как количество выделившегося кислорода в результате химической реакции пропорционально скорости образования побочного азокрасителя, то его количество можно определить из уравнения
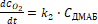 . (7)
. (7)
где 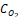 - концентрация кислорода, выделившегося при протекании побочной реакции, мг×л –1.
- концентрация кислорода, выделившегося при протекании побочной реакции, мг×л –1.
Тогда выражение примет вид
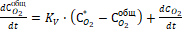 . (8)
. (8)
Процесс окислительной димеризации ПНТСК осуществляется при нагревании реакционной массы, поэтому необходимо определить влияние температуры на равновесную и текущую концентрации растворенного кислорода и определить функции 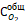 =f(T) и
=f(T) и 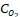 =f(T).
=f(T).
Энергетический баланс системы, в которой протекает реакция, определяется тепловой энергией и работой. Поэтому его можно записать в виде:
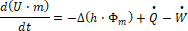 (9)
(9)
где U⋅m - общая внутренняя энергия системы, кДж;
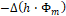 - изменение потока энтальпии;
- изменение потока энтальпии;
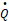 - скорость подвода тепла, кДж×с -1;
- скорость подвода тепла, кДж×с -1;
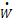 - поток энергии в окружающую среду, кДж×с -1.
- поток энергии в окружающую среду, кДж×с -1.
Внутренняя энергия и энтальпия системы связаны между собой соотношением:
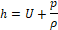 (10)
(10)
где p - общее давление в системе, Па;
ρ - плотность системы, кг×м -3.
Реакционный объем Vr в результате реакции увеличился на dVr, поэтому поток энергии в окружающую среду 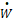 можно представить в виде:
можно представить в виде:
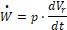 (11)
(11)
Выражение, описывающее кинетику подвода тепла, зависит от способа нагрева реакционной массы. В случае подвода тепла через поверхность теплообмена площадью F, 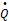 будет равно:
будет равно:
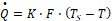 (12)
(12)
где K - общий коэффициент теплопередачи, кДж×(м2×с) -1;
T - температура реакционной смеси, °С;
TS - температура теплоносителя, °С.
Процесс окислительной димеризации ПНТСК проводят в емкостном реакторе периодического действия.
В емкостном реакторе периодического действия общая масса реакционной смеси постоянна, а интенсивное перемешивание позволяет поддерживать во всех точках объема одинаковые условия.
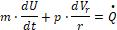 (13)
(13)
Рассмотрим это уравнение совместно с уравнением материального баланса реактора:
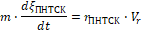 (14)
(14)
или
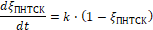 (15)
(15)
где 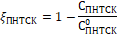 - относительная степень превращения ПНТСК, доля превращенного вещества;
- относительная степень превращения ПНТСК, доля превращенного вещества;
rПНТСК - массовая скорость превращения ПНТСК на единицу объема, кг·м-3·сек-1.
Окислительную димеризацию ПНТСК можно проводить как в открытых сосудах (при постоянном давлении), так и в автоклавах (при постоянных объеме). Использование автоклава для получения ДНС позволяет более полно использовать в реакции кислород воздуха, однако эксплуатация и обслуживание автоклава требует больших материальных затрат. Проведение окисления ПНТСК при постоянном давлении (в открытых сосудах) приводит к увеличению выхода побочного продукта - 4,4'-диметилазобензол-3,3'-дисульфокислота.
Для процессов при постоянном давлении, тепловой баланс, с использованием уравнений (13), (14) и (15), запишется в виде:
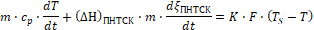 (16)
(16)
где (ΔН)ПНТСК - тепловой эффект реакции при превращении единицы массы ПНТСК, Дж×кг -1.
Первое слагаемое 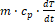 выражает теплоту реакционной смеси при изменении температуры
выражает теплоту реакционной смеси при изменении температуры 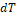 в момент времени
в момент времени 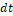 .
.
Второе - 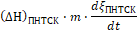 - количество тепла выделившегося в результате химической реакции при изменении степени превращения dξПНТСК к моменту времени dt .
- количество тепла выделившегося в результате химической реакции при изменении степени превращения dξПНТСК к моменту времени dt .
В выражении (16) неизвестной величиной является тепловой эффект реакции 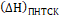 . Для жидкостей:
. Для жидкостей:
E = ΔH + R·T (17)
где E - энергия активации, Дж×кг -1;
DH - тепловой эффект реакции, Дж×кг -1.
Различие между E и ΔH незначительно, т.е. ΔH = E. Тепловой эффект реакции рассчитываем по разнице теплот образования конечных и исходных продуктов реакции [3].
Суммарное уравнение реакции дегидрирования ПНТСК имеет вид:
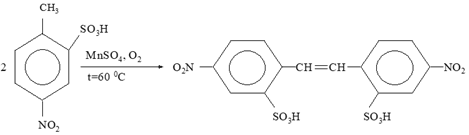
Теплота реакции окислительной димеризации ПНТСК рассчитывается следующим образом:
ΔHреак = (ΔHобр)ДНС - (ΔHобр)ПНТСК (18)
ΔHреак = 23,14 - ( - 4,26) = 27,4 ккал/моль.
Следует заметить, что величина теплового эффекта реакции окислительной димеризации ПНТСК близка к величине теплового эффекта реакции дегидрирования этана (21,4 ккал/моль). Это подтверждает предположение, что реакция окислительной димеризации ПНТСК имеет ступенчатый характер, т.е. происходит последовательное окислительное дегидрирование молекулы ПНТСК по схеме:
ПНТСК  ДНДБ
ДНДБ ДНС.
ДНС.
Уравнения (1-9) являются математическим описанием процесса окислительной димеризации ПНТСК в ДНС.
Выводы
Предложена математическая модель кинетики процесса окислительной димеризации 4-нитротолуол-2-сульфокислоты.
Рассмотрена термодинамика процесса окислительной димеризации 4-нитротолуол-2-сульфокислоты в емкостном реакторе периодического действия. Показано, что тепловой эффект реакции равен по величине и обратный по знаку тепловому эффекту реакции гидрирования олефинов.

.png&w=640&q=75)