Среди гетероциклических соединении бициклические гетероциклы, содержащие имидазо[2,1-b][1,3,4]тиадиазольные кольца, известны как биоактивные соединения, обладающие антитуберкулёзными, антимикробными и антигельментными действиями [1, с. 5657, 2, с. 540; 3, с. 145]. Кроме того, они представляют значительный интерес с точки зрения стереохимии данных гетероциклов. В настоящее время известно большое число методов синтеза производных имидазо[2,1-b][1,3,4]-тиадиазолов. В частности, синтезируют их на основе циклизации 2-R-5-амино-1,3,4-тиадиазола и α-галогенкетонов [4, с. 65; 5, с. 237; 6, с. 819; 7, с. 575; 8, с. 237; 9, с. 168]. Однако, о синтезе этил 2-бромо-5-карбоксилат-6-гидроксиимидазо[2,1-b][1,3,4]-тиадиазолa и 2-бромо-6-винил-имидазо[2,1-b][1,3,4]тиадиазолa на основе 2-R-5-амино-1,3,4-тиадиазол и 3-бромобутан-2-она еще систематически не изучено.
Синтез производных имидазо[2,1-b][1,3,4]тиадиазолов на основе винилацетилбромида (1-бромобут-3-ен-2-он) и диэтилового эфира α-броммалоновой кислоты практически не изучено, хотя исследуются с целью получения производных триазола [10, с. 16] и 1,3,4-тиадиазоло-[3,2-a]-пиримидинов [11, с. 120]. Благодаря их реакционной способности, они представляют значительный интерес для синтеза разнообразных гетероциклов. Ранее, [12, с. 65; 13, с. 32] мы исследовали синтез 2-R-6-хлорметиленимидазо[2,1-b][1,3,4]тиадиазола и 2-метилтио-7-хлор-метилен-5-оксо-5Н-1,3,4-тиадиазоло-[3,2-a]-пиримидина при взаимодействии 1,3-дихлорацетона и 4-хлорацетоуксусного эфира с 2-R-5-амино-1,3,4-тиадиазолом в среде этанола и полифосфорной кислоты. Эти два типа соединений, которые получены сложным путем, представляют исходные соединения для синтеза серии производных конденсированных 1,3,4-тиадиазола.
В настоящей работе, с целью продолжения работы по синтезу бициклических азо- и серосодержащих гетероциклических соединений, нами, исследованы реакции винилацетилбромида и диэтилового эфира α-бром-малоновой кислоты с 2-бром-5-амино-1,3,4-тиадиазолом в среде этанола.
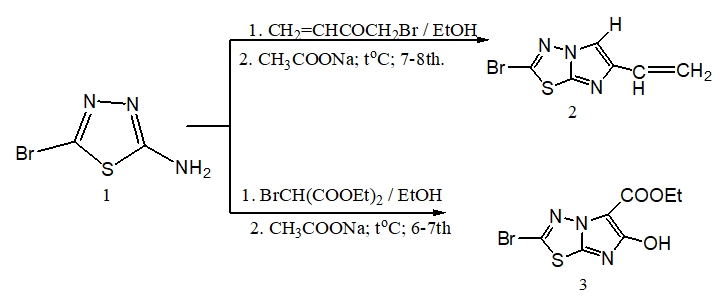
Реакция 1 с винилацетилбромидом очень гладко и энергично протекает в среде этанола. В результате реакции при охлаждении образуется соединение 2 из спиртового раствора в индивидуальном виде. После чего, обрабатываем реакционную смесь ацетатом натрия, получаем соединение 2 с выходом 65 %.
По аналогичной схеме соединение 1 реагирует с диэтиловым эфиром α-броммалоновой кислоты. Реакция протекает в две стадии. В этом случае, в отличие от взаимодействия с диэтиловым эфиром малоновой кислоты [14, с. 268], отщепляется бромоводород и образуется диэтиловый эфир 2-(5-бромо-2-иминогидробромида-1,3,4-тиадиазол-3(2Н)-ил)-малоната (1а), после нейтрализации ацетатом натрия выпадает белый осадок. Затем при дальнейшей циклизации соединения 1а в среде этанола с хорошим выходом образуется соединение 3. Механизм реакции протекает по следующей стадии:
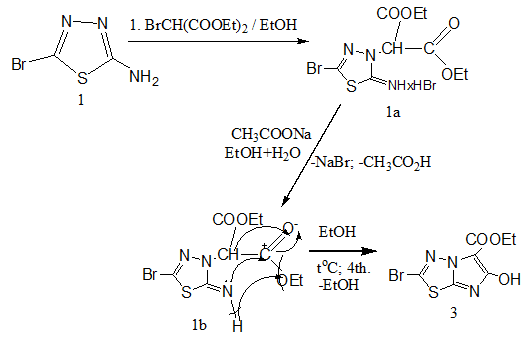
Как видно из схемы реакции и согласно [14, с. 248], после нейтрализации 1а происходит внутримолекулярная нуклеофильная атака между атомами азота иминногруппы и углерода карбонильной группы. При отщеплении атома водорода иминной группы и этоксигрупп, и внутримолекулярной перегруппировки α-водорода на кислород карбонильной группы, образуется соединение 3.
Чистоту и ход реакции образования соединений 2 и 3 контролировали тонкослойной хроматографией, а строение данного соединение установлено методом ИК-спектроскопией и элементного анализа (табл. 1 и 2).
ИК-спектры поглощения. В ИК-спектре соединения 1 в кристаллическом состоянии наблюдается полоса поглощения в области 1640 см-1 для С=N-фрагмента тиадиазольного цикла, а полоса поглощения для С=N-фрагмента имидазольного кольца проявляется в области 1526 см-1. Полоса поглощения в области 1432 см-1 соответствует валентным колебаниям двойной связи С=С-фрагмента имидазольного кольца. Полоса поглощения С-S-C для тиадиазольного кольца была обнаружена в области 686 см-1. Полоса поглощения в области 604 см-1 характерна для 2-С-Br-тиадиазольного фрагмента.
Для соединения 2 имеющая полосу поглощения в области 1637 см-1 соответствуют валентным колебаниям С=N-фрагмента тиадиазольного кольца, а полоса поглощения в области 1598 см-1 соответствует валентным колебаниям С=N-фрагмента имидазольного кольца. Характерная полоса поглощения в области 680 см-1 соответствует валентным колебаниям C-S-C-фрагментам. Полоса поглощения в области около 1438 см-1 соответствует валентным колебаниям С=С-фрагмента для имидазольного кольца. Для 2-C-Br полоса поглощения обнаружена в области 604 см-1.
Исходя из этого, можно утвердить структуры имидазо-тиадиазольных фрагментов соединений 1 и 2, что соответствуют литературным данным [15, с. 5496; 16, с. 58]. Далее перед нами стоит интерпретация заместителей в положении 5 и 6 соединений 2 и 3.
Таким образом, в ИК-спектре соединения 1 наличие винилгруппы обнаружено в полосах поглощений при 3093 см-1, а также обнаружена полоса поглощения при 1316 см-1, что свидетельствует о наличии плоских деформационных колебаний =С-Н [17] (рис. 1).
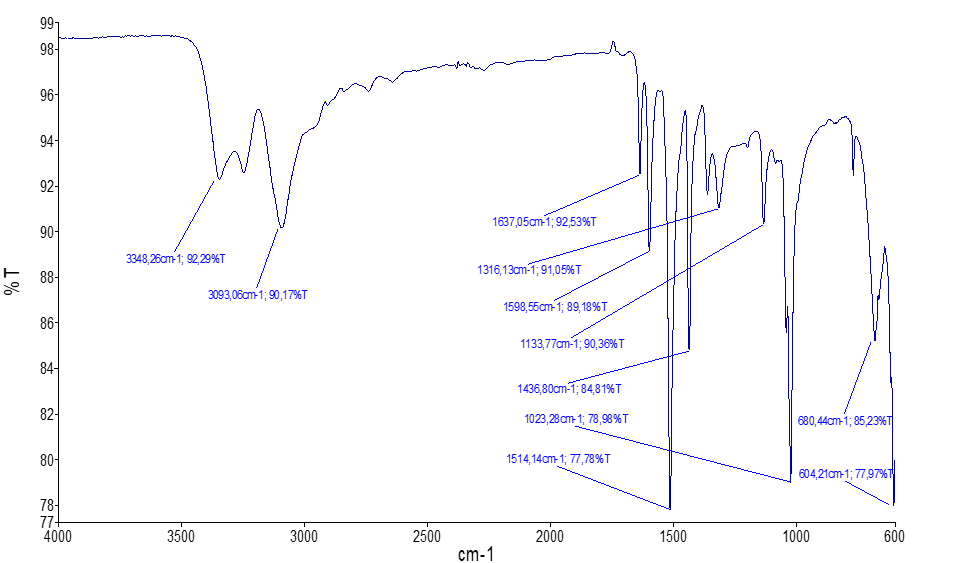
Рис. 1. ИК-спектр 2-бром-6-винилимидазо[2,1-b][1,3,4]тиадиазола (2)
В ИК-спектре соединения этил 2-бромо-6-гидроксиимидазо[2,1-b][1,3,4]-тиадиазол карбоксилата (3) (рис. 2) характерные полосы поглощений бицикла для С=N-имидазо-тиадиазольного фрагмента обнаружены в интенсивных областях 1598 см-1 и 1637 см-1, а для С=С-имидазольного фрагмента по сравнению с соединением 2 наблюдается полоса поглощения в области 1438 см-1. Появление полосы поглощения C-S-C обнаружено в области 680 см-1. Полоса поглощения 2-С-Br-экзоциклической группы тиадиазольного фрагмента наблюдается в области 604 см-1. Полоса поглощения 6-ОН-группы проявлена в области 3349 см-1, свидетельствует о наличии ее внутримолекулярной водородной связи хелатного типа карбонильной группы, а также полоса в области 860 см-1 отнесена к неплоским деформационным колебаниям. Полоса поглощения характерна карбонильной группе 5-этилкарбоксилата обнаружена в области 1742 см-1.
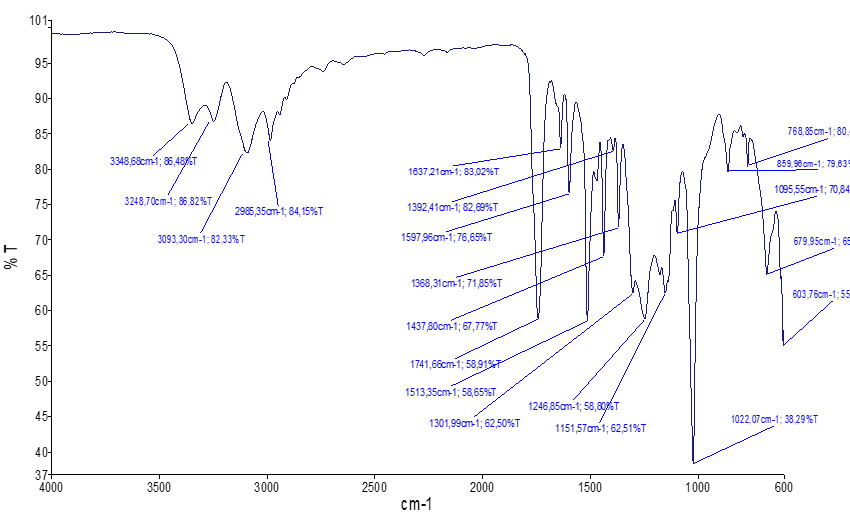
Рис. 2. ИК-спектр этил 2-бромо-6-гидроксиимидазо-[2,1-b][1,3,4]-тиадиазол карбоксилата (3)
Характерные полосы поглощений относящейся к С-О-C и СН2 обнаружены в областях 1302, 2985 см-1 а для δСН3 частота колебания проявлена в области 1368 см-1, что свидетельствуют о наличии влияния карбонильной группы на этоксигруппу [18, с. 61].
Таблица 1
Отнесение полосы поглощении для соединений 2 и 3
|
№ соединение |
Полоса поглощения, см-1 | ||||
|
C=N (тиадиазольный фрагмент) |
C=N (имидазольный фрагмент) |
С=С (имидазольный фрагмент) |
С-S-C (тиадиазольный фрагмент) |
Экзоциклические функциональные группы | |
|
2 |
1640 |
1526 |
1432 |
686 |
604 для С-Br; 3093 для =CH; 1316 для плос. деф. кол. =С-Н. |
|
3 |
1637 |
1598 |
1438 |
680 |
604 для С-Br; 3349 для ОН; 860 для непл. деф. кол. ОН; 1742 для С=О; 1302 для С-О-С; 2985 для СН2; 1368 для СН3. |
Таким образом, в ИК-спектрах полученных соединений, обнаружены характерные полосы поглощения имидазо-тиадиазольного цикла, экзоциклические функциональные группы 2, 5 и 6 положении и другие полосы, относящиеся к данным гетероциклам. Выявлено, что в соединении 2 ОН-группа обнаружена не в свободном виде, а в виде очень широкой размытой полосы поглощения хелатного типа водородной связи. А также, под влиянием заместителей 2, 5 и 6-ых положений гетероцикла и влияние +М, -М и -I-эффектов кислорода карбонильной группы, которые изменяют распределение электронной плотности в соединениях 2-3, и этим изменяется относительная интенсивность некоторых пиков, в частности интенсивность валентных колебаний атомов в кольце. Исследование ИК-спектров поглощения вышеуказанных производных имидазо[2,1-b][1,3,4]-тиадиазолов имеют характерную зависимость от их строения и могут быть использованы для идентификации соответствующих соединений, а также для определения положения заместителей в имидазо[2,1-b][1,3,4]-тиадиазольном кольце.
Таблица 2
Физико-химические свойства синтезированных соединений
|
№ соед |
Выход, % |
Т.пл., оС |
Вычислено, % |
Найдено, % |
Брутто-формула | ||||
|
С |
Н |
N |
С |
Н |
N | ||||
|
2 |
65 |
176-177 |
31.30 |
1.74 |
18.26 |
31.60 |
1.54 |
18.60 |
C6H4BrN3S |
|
3 |
57 |
187-188 |
28.77 |
2.05 |
14.38 |
28.90 |
2.10 |
14.45 |
C7H6BrN3SO3 |
Данные элементного анализа С, Н и N для соединений 2 и 3 совпадают с расчетными данными.
Экспериментальная часть. ИК-спектры были сняты на приборе Perkin Elmer Spectrum. Элементный анализ был проведен в микроаналитической лаборатории Университета Degli L’Aquila Италии. Чистота полученных соединений и ход реакций контролировали тонкослойной хроматографией на стандартных пластинках “Silufol UV-254” в системах дибутиловый эфир-бутанол-1 (2:1); этилацетат-диэтиловый эфир (1:1); дибутиловый эфир-этанол (3:1), пятна проявлены в парах йода. Температуры плавления определены на приборе «Boetus».
- Синтез 2-бромо-5Н-6-винилимидазо[2,1-b][1,3,4]тиадиазолa (2).8 г (0.01 моль) 2-амино-5-бром-1,3,4-тиадиазола (1) помещают в 20 мл этанола и добавляют эквимолярное количество винилацетилбромида. Смесь перемешивают при нагревании в течение 7-8 часов. Затем реакционную смесь охлаждают, нейтрализуют 0.82 г (0.01 моль) ацетатом натрия. Выпавший осадок отфильтровывают и промывают 100 мл холодной воды, сушат на воздухе 12 часов. Перекристаллизовывают из смеси бутанол-спирт (4:1). Выход составляет 1.49 г (65 %). Тпл.= 176-177оС.
- Синтез этил 2-бромо-5-карбоксилат-6-гидроксиимидазо[2,1-b][1,3,4]-тиадиазолa (3).8 г (0.01 моль) соединения 1 растворяют в 20 мл этанола, при перемешивании добавляют 2.29 г (0.01 моль) диэтилового эфира α-броммалоновой кислоты. Реакционную массу перемешивают при нагревании в течение 2 часов, затем охлаждают и нейтрализуют 0.82 г (0.01 моль) ацетатом натрия. Выпавший осадок отфильтровывают и промывают 100 мл холодной водой, сушат на воздухе 12 часов. После высушивания реакционную смесь перемешивают в 20 мл этанола, и еще раз нагревают в течение 4 часов. Затем реакционную смесь охлаждают и переносят в сосуд, содержащий 50 мл ледяной воды. Выпавший осадок отфильтровывают и промывают 100 мл холодной водой, сушат на воздухе 12 часов, перекристаллизовывают из этанола (2:4). Выход составляет 1.66 г. (57 %). Тпл.= 187-188оС.

.png&w=640&q=75)