Развитие прикрепленных сообществ – одна из основных стратегий выживания бактерий и в окружающей среде, и в организмах инфицируемых хозяев [1]. Формирование биопленок отмечено у большинства бактерий в природных, промышленных и клинических условиях [6,3], в то же время конкурентоспособность штаммов авторы связывают со степенью выраженности их пленкообразующей способности [4,10]. Особое значение это свойство приобретает в контексте персистенции возбудителей и хронизации патологического процесса, поскольку структура биопленки, а также физиологические свойства объединенных в сообщество бактерий, обеспечивают повышение устойчивости к воздействию неблагоприятных факторов физической, химической и биологической природы, как во внешней среде, так и в организме хозяина [2]. К настоящему времени достоверно доказана роль микробных биопленок в возникновении и развитии целого ряда заболеваний, которые трудны для лечения, имеют высокую частоту рецидивов, а некоторые из них могут становиться причиной снижения функциональной активности тех или иных органов и систем. В связи с нарушениями у мужчин репродуктивной функции роль инфекционных процессов, в том числе связанных с формированием микробных биофильмов, дискутируется. Далеко не до конца ясны механизмы, благодаря которым микроорганизмы, образующие биопленки, вызывают патологические изменения в половых органах, ускользая от многочисленных защитных факторов, вырабатываемых клетками и тканями этого биотопа.
Как известно, секреты мужских репродуктивных органов отличаются высоким содержанием спермина и спермидина, окисленные производные которых способны влиять на рост и размножение бактерий. К тому же воспалительные процессы и присутствие упомянутых соединений в значительной степени определяют показатель кислотности среды, что также сказывается на ростовых характеристиках микроорганизмов. В этой связи целью исследования явилось изучение пленкообразующей способности культур E. faecalis, изолированных от условно здоровых и от страдающих бесплодием мужчин, в присутствии спермальных полиаминов.
Материалы и методы. В работе были изучены штаммы E. faecalis, выделенные от инфертильных и от условно здоровых мужчин. Подобный выбор объясняется тем, что по результатам наших предшествующих исследований [5] при патоспермии, обусловленной условно патогенными микроорганизмами, E. faecalis изолировали чаще других представителей аутофлоры. Эталоном служил штамм E. faecalis АТСС 29212, полученный из ФГБУ «ГИСК им. Л.А. Тарасевича» Минздрава РФ (Москва).
В серии экспериментов оценивали пленкообразующую способность штаммов E. faecalis по методике O`Toole G.F. и соавторов [9] в диапазоне показателя кислотности от 6 до 10 в отсутствии либо при добавлении различных концентраций спермина, спермидина, а также обоих полиаминов одновременно. Ночные культуры E. faecalis, выращенные на бульоне Луриа-Бертани (LB-бульон) и стандартизованные до 0,5 по МакФарленду, количественно засевали в полистироловые плоскодонные 96-луночные панели (стандартизованную культуру разводили 1:100), содержащие компоненты, соответствующие задачам эксперимента: LB-бульон с добавлением спермина и солянокислого спермидина, используя их двукратные разведения (от исходного раствора до разведения 1:32); для контроля – чистый LB-бульон. Исходная концентрация соответствовала содержанию полиаминов в спермоплазме, установленному нами ранее: 0,04 мг/мл для спермидина и 0,5 мг/мл для спермина [5]. Для достижения необходимых показателей рН среды использовали соляную кислоту и гидроокись натрия. Количество жизнеспособных микроорганизмов подсчитывали при высеве стандартных десятикратных разведений бактериальных взвесей на кровяной агар. Полученные данные обрабатывали с использованием методов вариационной статистики. При статистической обработке результатов вычисляли среднее значение и его ошибку. В качестве графических примеров приведены характеристики штаммов E. faecalis №11 и № 8, типичных для выделенных от больных и от условно здоровых мужчин соответственно.
Результаты. Все исследованные культуры E. faecalis при выращивании в стандартной среде (LB; рН=6) в той или иной степени проявляли пленкообразующую способность (рис. 1). Разброс значений этого показателя позволяет говорить о штаммовой специфичности данного признака. Однако при анализе уровня пленкообразования с учетом анамнеза пациентов выявлены следующие особенности: наиболее «мощную» пленку формировали, как правило, штаммы, изолированные от условно здоровых мужчин, а минимальную пленкообразующую способность демонстрировали культуры, рассматриваемые как этиопатогены. Такое распределение очевидно связано с характером взаимоотношений с макроорганизмом (колонизация/инфекция) и, соответственно, своеобразием их «стратегии выживания». Вполне вероятно, что в когорте условно здоровых пациентов оказались и мужчины с хронической инфекцией в латентный период. Способность к персистенции в тканях человека связана с высоким уровнем пленкообразования, обеспечивающим закрепление и выживание инфекта, несмотря на воздействие защитных сил организма [8]. В группе больных доминировали случаи острых инфекций либо хронических, но в период обострения, что подразумевает активное размножение бактерий и наличие минимального количества покоящихся форм.
С другой стороны, формирование бактериальных биопленок – многоступенчатый процесс, каждый этап которого в значительной степени зависит от большого набора внешних факторов. Вполне вероятно, что реакция на их изменения будет идентичной у культур, изолированных в однотипных клинических ситуациях. Ее направленность и степень выраженности может служить дополнительным критерием в оценке этиологической роли изолята. Прежде всего, при воспалительном процессе может существенно изменяться показатель кислотности среды. В этой связи в первой серии экспериментов значения рН мы рассматривали как самостоятельный фактор, способный повлиять на уровень пленкообразования культур E. faecalis. Как и ожидалось, штаммы, изолированные от различных пациентов, по-разному отзывались на изменение данного параметра (рис.1). Наиболее выраженным оказался отклик на защелачивание среды штаммов от условно здоровых пациентов, при этом чем выше было значение рН, тем более массивную пленку образовывали бактерии. На уровень пленкообразования этиопатогенов кислотность значимого влияния не оказывала, а референтный штамм достоверно увеличивал пленку только при рН=9. Как известно, энтерококки способны активно размножаться в широких диапазонах рН. Прослеженный нами ответ различных изолятов на защелачивание среды in vitro гипотетически можно рассматривать как модель «поведения» энтерококков in vivo. Штаммы, функционирующие как типичные этиопатогены, обусловливающие острое развитие инфекционного процесса, стремятся активно размножаться в тех условиях, какие существуют в очаге поражения. В то время как комменсалы, либо персистирующие инфекты, изолированные в латентный период хронического заболевания, избегая элиминации, переходят в сесильные формы и зачастую образуют многослойные пленочные сообщества.
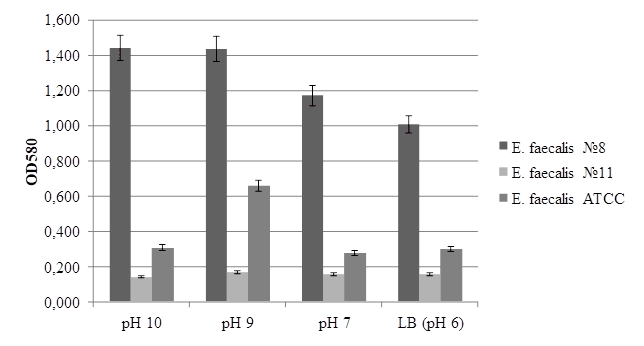
Рис. 1. Интенсивность пленкообразования E. faecalis при различных рН среды
Соединениями, ответственными за смещение рН секретов половых желез в щелочную сторону, считаются спермальные полиамины. Кроме того, известно, что спермин и спермидин могут подавлять экссудацию и стимулировать пролиферацию клеток при воспалении [7], оказывать антибактериальное действие, а их окисленные производные даже в очень малых концентрациях угнетают рост и размножение многих бактерий [11].
Следующий этап эксперимента был посвящен изучению пленкообразования при добавлении в среду культивирования этих поликатионов в разных концентрациях, с учетом изменения ими рН среды, либо в стандартизованных условиях, при показателе кислотности равном 7.
Добавление спермина в разных разведениях при рН=7 приводило к значительным изменениям интенсивности пленкообразования по сравнению с его уровнем в LB-бульоне без добавок (рис.1). В большинстве случаев регистрировали снижение массивности биопленок, формируемых культурами, выделенными от условно здоровых мужчин (рис.2). При этом отмечали дозозависимый эффект: минимальная пленкообразующая способность проявлялась при максимальном разведении спермина. Аналогичный отклик таких штаммов прослеживался и при добавлении спермидина. Однако их совокупное действие в значительной степени индуцировало процесс пленкообразования. Содержание полиаминов, близкое к физиологической норме, усиливало его в 1,5–2 раза по сравнению с LB-бульоном. Очевидно, что наибольшее влияние на пленкообразующую способность энтерококков, склонных к колонизации/персистенции, оказывает одновременное присутствие спермина и спермидина, при этом эффект зависит от их концентрации в среде.
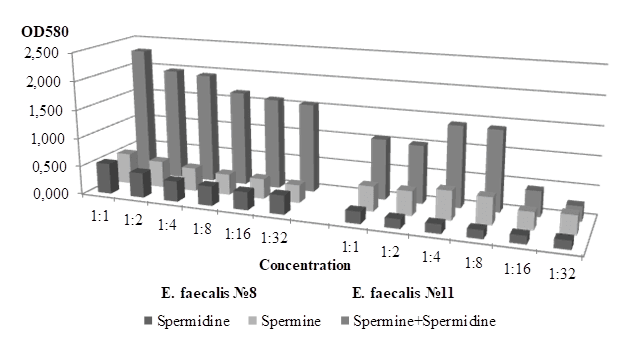
Рис. 2. Интенсивность пленкообразования E. faecalis в присутствии полиаминов в разных разведениях (рН=7)
Культуры, изолированные от пациентов с патоспермией, отзывались на внесение в среду культивирования спермина прямо противоположным образом (рис.2). Сформированные ими биопленки были в несколько раз массивней по сравнению с образованными в LB-бульоне, что в наибольшей степени проявлялось при разведениях этого полиамина 1:4–1:8. Добавление различных концентраций спермидина практически никак не сказывалось на пленкообразующей способности изолятов. Совместное присутствие обоих поликатионов стимулировало процесс пленкообразования, как и в отношении штаммов, изолированных от условно здоровых мужчин. Максимальная пленкообразующая способность проявлялась также в разведениях 1:4 и 1:8, что косвенно указывает на определяющее влияние спермина на способ существования этиопатогенов. Возможно, именно такая его концентрация характерна для хронического течения инфекционного процесса, когда преобладают сесильные, структурированные в пленку бактериальные сообщества.
В заключительной серии экспериментов изучали пленкообразование при одновременном воздействии двух факторов: различных концентраций спермина и изменяющихся уровней рН среды, а также обоих полиаминов в аналогичных условиях. Пленкообразующая способность штаммов, изолированных от условно здоровых пациентов, снижалась в присутствии спермина, однако степень выраженности его влияния в значительной мере зависела от показателя рН. Минимальный уровень пленкообразования был отмечен при резко щелочной реакции среды (рис.3).
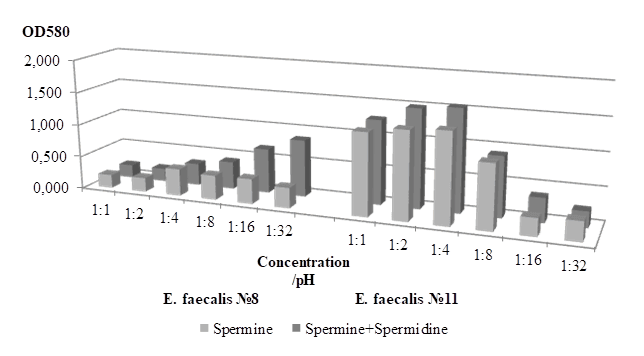
Рис. 3. Интенсивность пленкообразования E. faecalis в присутствии полиаминов в разных разведениях и при различных рН
Подобным образом культуры реагировали и на одновременное присутствие обоих поликатионов, хотя достоверно активнее пленки образовывались при показателе рН=7–7,5, что соответствовало максимальному разведению спермина и спермидина. Очевидно, что на штаммы комменсалов физиологические концентрации полиаминов в условиях повышенной кислотности оказывают антибактериальное действие, в то время как снижение их содержания и, соответственно, рН, может способствовать колонизации/персистенции.
Эффект воздействия спермина при соответствующих рН на штаммы-этиопатогены оказался самым неожиданным и отличался как от проявившегося при скомпенсированном рН, так и от установленного в отношении персистирующих штаммов (рис.3). Этиопатогены формировали самые массивные пленки при высоких концентрациях спермина и обусловленной им щелочной реакции среды. Важно подчеркнуть, что при добавлении обоих полиаминов, как и в предыдущих экспериментах (рис.2), именно спермин играл решающую роль.
Выводы. Таким образом, полученные нами результаты подтверждают мнение исследователей о способности спермальных полиаминов влиять на бактериальную флору, в том числе E. faecalis. Отклик штаммов, изолированных от условно здоровых и от инфертильных мужчин, отличается заметным своеобразием. Стратегии их выживания, прослеженные in vitro, гипотетически можно рассматривать как модель «поведения» энтерококков in vivo в зависимости от различных «сценариев» развития инфекционного процесса. В регуляции пленкообразующей способности изолированных при этом штаммов в специальных экспериментальных условиях установлена определяющая роль спермина. Совокупное действие выбранных полиаминов на формирование биопленок проявляется в полной мере при определенных значениях рН окружающей среды.

.png&w=640&q=75)