Актуальность. В настоящее время в мире отмечается прогрессирующее нарастание числа пациентов с хронической почечной недостаточностью (ХПН). При этом трансплантация почки (ТП) остается предпочтительным методом лечения для больных с терминальной стадией почечной недостаточности [1].
Реципиенты почечного трансплантата имеют повышенный риск развития сердечно-сосудистых заболеваний (ССЗ), которые являются ведущей причиной смерти. Распространенность кардиоваскулярных событий в исследовании FAVORIT составила 20% среди участников [2]. Сердечно-сосудистые риск-факторы являются общими (артериальная гипертония или использование гипотензивных препаратов, пограничный/повышенный уровень липопротеинов низкой плотности (ЛНП) или использование гиполипидемической терапии, наличие сахарного диабета и ожирение) [3, 4, 5, 6].
Для предотвращения ССЗ у пациентов после трансплантации почки оценка сердечно-сосудистого риска должна проводится регулярно. Профилактика включает в себя изменение образа жизни, оптимальное лечение кардиоваскулярных событий и стратегию по сохранению функции трансплантата [7]. При этом в литературе имеется ограниченное количество исследований, оценивающих вклад цитомегаловирусной инфекции (ЦМВ) в развитии атерогенеза у реципиентов поченого трансплантата [8].
Цель. Выявить взаимосвязь между ЦМВ и атеросклеротическим поражением артерий брахиоцефального ствола (БЦС) у пациентов после ТП наряду с основными сердечно-сосудистыми факторами риска.
Материалы и методы. Обследовано 172 пациента после ТП, находящихся на стационарном лечении в нефрологическом отделении Клиник СамГМУв период с сентября 2009 по май 2012 года. Среди них 108 мужчин (62,8%) и 64 женщины (37,2%).Средний возраст составил 42,2±2,9 года.
Причиной терминальной ХПН, учитывая анамнез и предшествующие обследования, в 52% случаев явился хронический гломерулонефрит, в 22% – хронический пиелонефрит, в 19% - тубулоинтерстициальный нефрит, в 7 % – поликистоз почек. 60% пациента проходили ранее заместительную почечную терапию методом программного гемодиализа, 9,3% методом перитонеального диализа. У 40,5% больных наблюдалась хроническая дисфункция и у 59,5% сохранная функция трансплантата.
Всем пациентам выполнялись общеклинические исследования, включающие общий и биохимический анализ крови, в том числе определение липидного спектра (общий холестерин (ОХ), липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛПВП), триглицериды(ТГ). Всем пациентам выполнялась трансторакальная эхокардиография, ультразвуковое исследование органов брюшной полости на аппарате MedisonSonoAceR7 c использованием конвексного датчика, денситометрия с целью выявления уровня потери костной массы на аппарате Денситометр ДНС-2.
Функцию трансплантированной почки определяли по уровню креатинина (рассчитывалась скорость клубочковой фильтрации по формуле MDRD) и ультразвуковому исследованию.
Для выявления характера и степени выраженности поражения атеросклерозом экстракраниальных отделов брахиоцефальных артерий (общие (ОСА), внутренние (ВСА), наружные сонные артерии, позвоночные, подключичные артерии (ПКА)) использовали ультразвуковое триплексное сканирование. Исследование проводилось на ультразвуковых сканерах Logiq – 5;7 (США) мультичастотным линейным датчиком 4-10 МГц и мультичастотным конвексным датчиком 2,5-5 МГц.
Применялся иммуноферментный анализ с измерением титра антител класса IgG и IgМ к ЦМВ. Все пациенты были разделены на две группы в зависимости от наличия ЦМВ: 1 группа – 85 пациентов с отсутствием ЦМВ и 2 группа – 87 пациентов с наличием ЦМВ.
Статистическая обработка результатов проводилась с помощью пакета прикладных программ Statistica 6.1. Отношение шансов определяли регрессионным анализом Кокса. При проведении корреляционного анализа применяли корреляцию Спирмена. Различия считали достоверными при р<0,05.
Результаты исследования. Регрессионный анализ показал, что экспозиция ЦМВ (отношение шансов 1.9 (95% доверительный интервал, 1.08-3.02), р=0,03) является независимым фактором риска атеросклеротического поражения артерий БЦС. При анализе корреляционных взаимосвязей ЦМВ со стенозами артерий БЦС были выявлены достоверные корреляции умеренной силы между ЦМВ и стенозами ОСА (R=0,54, р<0,01), ЦМВ и стенозами ВСА (R=0,48, р<0,01), ЦМВ и стенозами ПКА (R=0,33, р<0,01) (рис.).
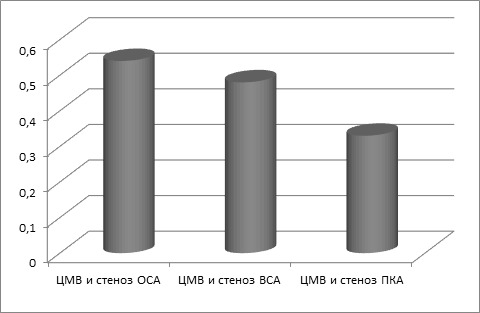
Рис. Корреляции ЦМВ и стенозов артерий БЦС
Не было выявлено достоверных различий между группами по уровню ОХ, ЛПНП, ЛПВП, ТГ.
Обсуждение полученных результатов. Наши данные показывают корреляцию ЦМВ с атеросклеротическим поражением артерий БЦС, что может свидетельствовать об участии инфекционного агента в процессе атерогенеза. Так Courivaud C. (2013) впервые продемонстрировал, что ЦМВ – значимый фактор больших кардиоваскулярных событий у реципиентов почечного трансплантата [8]. Влияние инфекции обусловлено опосредованным воздействием на сосудистую стенку через воспаление и стимуляцию иммунного ответа. Реактивация ЦМВ может ускорить процесс атерогенеза путем увеличения тканевой инвазии за счет пролиферации и миграции гладкомышечных клеток [9]. При этом как предтрансплантационная экспозиция ЦМВ, так и репликация ЦМВ после трансплантации способствует атеросклеротическим изменениям и увеличению риска сердечно-сосудистых заболеваний.
Выводы. Экспозиция ЦМВ наряду с традиционными факторами может способствовать увеличению риска атерогенеза у реципиентов почечного трапсплантата, что ухудшает дальнейший прогноз. С целью увеличения выживаемости данных пациентов следует применять гипериммунный цитомегаловирусный иммуноглобулин с целью профилактики ЦМВ, ассоциированной с трансплантацией почек, или проводить диагностику ЦМВ с последующим назначением противовирусной терапии.

.png&w=640&q=75)