В последние несколько десятилетий активно развивается направление исследований в области фармацевтической химии, косметологии и медицины, связанное с поиском новых комплексных соединений гетероциклических органических лигандов с катионами Fe2+, Mn2+, Ni2+, Co2+, Cu2+, обладающими высокой биологической активностью [7, с. 16]. Для таких металлокомплексов характерно проявление более выраженных антимикробных и антивирусных свойств, чем у исходных лигандов, благодаря сочетанию и взаимному усилению в одном таком веществе различных видов активности [6, с. 54].
В настоящее время для лечения различных бактериальных инфекций и в качестве противопротозойного агента широко используется метронидазол - 1-(b-оксиэтил)-2-метил-5-нитроимидазол, который имеет в своем составе донорный атом азота и легко вступает в реакции комплексообразования с переходными металлами. Известны его координационные соединения с ионами Fe2+ и Ni2+ состава Ме:L=1:2, обладающие более высокой активностью в отношении Candida tropicalis, чем лиганд [5, с. 1].
Поэтому, можно предположить, что и производные метронидазола [1]: (2 - (5-нитро-1H-имидазол-1-ил) этил 2 - (9-тиооксоакридин-10 (9H) - ил) ацетат (L1), 2-метокси-N-(2 - (2-метил-5-нитро-1H-имидазол-1-ил) этил) акридин-9-амин (L2), 2 - (2-метил-5-нитро-1H-имидазол-1-ил) этил-2-((4 - (2 - (2-метил-5-нитро-1H-имидазол-1-ил) этокси) карбонил) фенил) амино) бензоат (L3), 2 - (2-метил-5-нитро-1H-имидазол-1-ил) этил 2 - ((3 - ((2 - (2-метил-5-нитро-1H-имидазол-1-ил) этокси) карбонил) фенил) амин) бензоат (L4), 2-(2-метил-5-нитро-1H-имидазол-1-ил)этил-(9-акридон-10-ил)ацетат (L5) участвуют в реакции комплексообразования с катионами металлов, а образующиеся координационные соединения обладают высокой биологической активностью.
Термодинамические константы депротонизации производных метронидазола лежат в диапазоне рК 1,77-2,02 (таблица 1) [3].
Таблица 1
Константы депротонизации производных метронидазола, Р=0,95, n=3
|
Лиганд |
К1 |
рК1 |
К2 |
рК2 |
|---|---|---|---|---|
|
L 1 |
0,13±0,05 |
0,86±0,09 |
1,00*10-2±0,35*10-2 |
2,00±0,13 |
|
L 2 |
9,64*10-3 ± 1,77*10-3 |
1,25 ± 0,13 |
1,66*10-2±0,29*10-2 |
1,77±0,15 |
|
L 3 |
1,91*10-2 ± 0,36*10-2 |
1,72 ± 0,08 |
9,50*10-3±0,25*10-3 |
2,02±0,02 |
|
L 4 |
2,48*10-2 ± 0,17*10-2 |
1,60 ± 0,03 |
1,20*10-2±0,12*10-2 |
1,88±0,05 |
|
L 5 |
- |
- |
1,00*10-2±0,25*10-2 |
2,00±0,09 |
Комплексообразование производных метронидазола с катионами металлов происходит в водно-этанольном растворое при рН 3,5-7,5. В этом диапазоне атом азота метронидазольного фрагмента соединения депротонирован, это позволяет предположить его участие в комплексообразовании.
Координационные соединения производных метронидазола с катионами Fe2+, Ni2+, Co2+ получали в этом диапазоне рН из водно-этанольных растворов соответствующих солей и лигандов. Навески хлоридов кобальта (II), нитрата никеля (II) и сульфата железа (II) квалификации «ч.д.а», а также лигандов растворяли в этиловом спирте на теплой водяной бане. Затем при постоянном перемешивании приливали раствор соли в этанольный раствор лиганда в мольном соотношении 1:1, а для L2 с солями железа(II) и никеля(II) в соотношении Ме:L=1:2, и оставляли на 5 часов при комнатной температуре. Затем отгоняли этиловый спирт из раствора комплексной соли, а образовавшиеся нерастворимые комплексы отфильтровывали под вакуумом, промывали этанолом для удаления не вступивших в реакцию металлов и лиганда, а затем высушивали в сушильном шкафу при 60°C.
Методом ИК-спектроскопии утановлен координационный узел комплексных соединений. Спектры L5 и его комплекса с ионами Со2+ представлены на рисунке 1, а спектр L3 и его комплекса с ионами Fe2+ на рисунке 2.
ИК-спектры лигандов и их комплексов имеют сходный характер, что доказывает присутствие лиганда в молекулах координационных соединений. Также в ИК-спектрах комплексов по сравнению со спектрами всех лигандов наблюдается изменение характера поглощения в области 1180-1300 см-1, а для комплексных соединений L3 и L4 с d-металлами появление новой полосы при 1627 см-1. Все это позволяет предположить, что лигандным атомом выступает азот пятичленного цикла метронидазольного фрагмента соединений. В результате L3 и L4 в комплексных соединениях ведут себя как бидентатные лиганды, а остальные как монодентатные. Полоса в области 3431-3436 см-1 доказывает наличие в структуре комплексного соединения кристаллизационной воды.
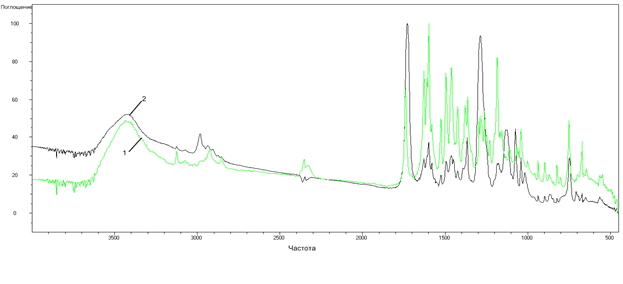
Рис. 1. ИК-спектр (KBr) L5 (1) и его комплекса с кобальтом (2): Ar-C=O – 1630 см-1; -C=C-(ar) – 1400 - 1500,7см-1; С–Н - 3125 – 3075 см-1, 2980 – 2849 см-1 ; С=Оэфирн - 1630 см-1 ; С=С, С=N 1611, 1597, 1581, 1495, 1460 см-1 ; NO2 – 1526 см-1 ; C-(ar) –N- 1180 см-1 [4, с.21-36]
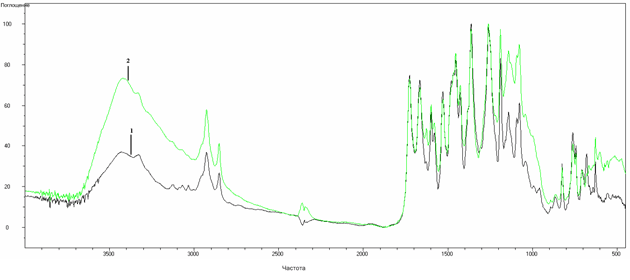
Рис. 2. ИК-спектр (KBr) L3 (1) и его комплекса с железом (2): Ar-COO-R – 1726,8 см-1; -C=C-(ar) – 1427, 1454, 1463см-1; С–Н - 3431см-1 ; С=С - 1460 см-1 ; NO2 – 1529,5 см-1 ; C-(ar) –N- 1261 см-1 ; C=N -1627 см-1 [4, с. 36 – 69]
Мольные отношения металл-лиганд в составе комплексов с ионами Fe (II), Ni(II), Co(II) в водно-этанольном растворе (9:1), а также некоторые физико-химические характеристики образующихся соединений определяли спектрофотометрически методом молярных отношений (по кривой «насыщения») по известным методикам [2, с. 214-216]. Оптическую плотность растворов лигандов и металлокомплексов в водно-этанольном растворе измеряли на спектрофотометре UV – 1800 SHIMADZU в диапазоне длин волн 200-400 нм с точностью ± 0,5 нм с использованием стандартной кварцевой кюветы с толщиной светопоглощающего слоя 10 мм.
Характер UV-спектров комплексных соединений с катионами металлов аналогичен спектрам производных метронидазола, наблюдается лишь гиперхромный или гипохромный эффект в спектрах поглощения металлокомплексов в диапазоне длин волн 250-300 нм. Спектры поглощения водно-этанольных растворов L3 и L3 в присутствии ионов Fe2+ (С=5*10-5 моль/дм3) при рН 4,06 представлены на рисунке 3.
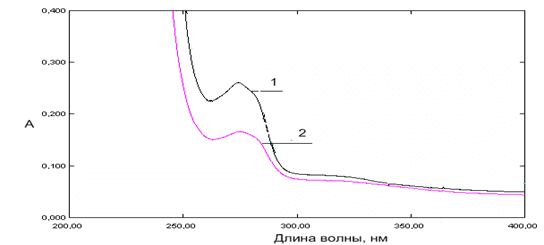
Рис. 3. Спектры поглощения водно-этанольных растворов L3 (1) и L3 в присутствии ионов Fe2+ (2) (С=5*10-5 моль/дм3) при рН 4,06
На рисунках 4-5 представлены кривые насыщения при постоянной концентрации лиганда и переменной концентрации металлов для комплексных соединений лигандов L1 и L2 с ионами Fe(II) и Ni(II). Точка излома на кривых насыщения отвечает отношению стехиометрических коэффициентов, которое равно отношению концентраций реагирующих компонентов в абсциссе точки эквивалентности. Таким образом, состав координационных соединений лигандов L1, L3-L5 с ионами Fe2+, Ni2+, Co2+– Ме: L=1:1, а для L2 с ионами Fe2+ и Ni2+ - 1:2 , с Co2+ также 1:1 .
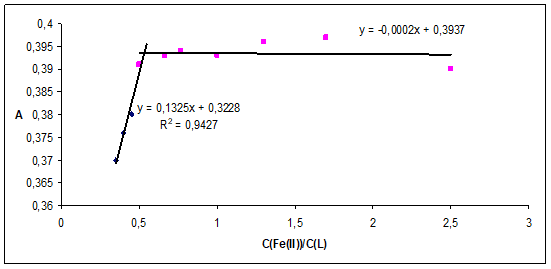
Рис. 4. Кривая насыщения для комплекса L2 с ионами железа (II): концентрация L2 3*10-5 моль/дм3 при λ=275 нм
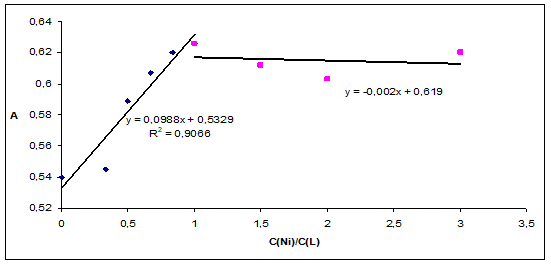
Рис. 5. Кривая насыщения для комплекса L1 с ионами никеля (II): концентрация L1 3*10-5 моль/дм3 при λ=275 нм
Следовательно, уравнение реакции комплексообразования лигандов L1, L3-L5 с ионами Fe2+, Ni2+, Co2+ имеет вид:
Mе2++L ↔ [MеL]2+.
А для L2 с ионами Fe2+ и Ni2+ :
Mе2++2L ↔ [MеL2]2+
Методом Комаря [2, с. 216-230] были установлены условные константы устойчивости каждого координационного соединения (таблица 2). Для этого приготовили ряд растворов со стехиометрическим отношением реагирующих компонентов С(L)/С(Ме)=n и измеряли оптические плотности полученных растворов при заданной длине волны (рис. 6). Полученные значения условных констант устойчивости соответствуют ряду Ирвинга-Вильямса.
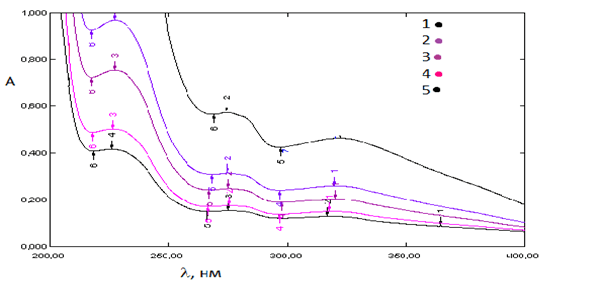
Рис. 6. Спектры поглощения комплексного соединения L5 с ионами Fe2+: 1 – С=2,5*10-5 моль/ дм3; 2 – С=1,25*10-5 моль/ дм3; 3 – С=8,35*10-6 моль/ дм3; 4 – С=6,3*10-6 моль/ дм3; 5 – С= 5*10-6 моль/ дм3
Таблица 2
Условные константы устойчивости для комплексных соединений P=0,95, n=6
|
Молекулярная формула |
β¢ комплексов с ионами Со2+ |
β¢ комплексов с ионами Fe2+ |
β¢ комплексов с ионами Ni2+ |
|---|---|---|---|
|
MeL1 |
1,69±0,89*105 |
1,57±0,34*105 |
1,70±0,64*105 |
|
MeL2 (Me(L2)2) |
3,06±1,81*105 |
2,47±0,90*108 |
4,19±1,89*109 |
|
MeL3 |
2,08±0,19*105 |
1,82±0,14*105 |
2,20±0,71*105 |
|
MeL4 |
1,20±0,31*105 |
2,50±0,50*104 |
1,28±0,43*105 |
|
MeL5 |
9,20±0,4*104 |
3,10±0,2*104 |
9,80±0,4*104 |
Таким образом, производные метронидазола с катионами 4d-металлов: Ni2+, Fe2+ и Co2+ в водно-этанольном растворе образует комплексные соединения состава Ме(II):лиганд = 1:1 и 1:2. Стехиометрия реакции комплексообразования установлена спектрофотометрически методом молярных отношений, условные константы устойчивости комплексов рассчитаны методом Комаря. По данным ИК-спектроскопии лигандов и комплексов показано, что сайтом связывания с исследуемыми катионами можно считать азот пятичленного цикла метронидазольного фрагмента соединения.

.png&w=640&q=75)