В настоящее время значительное внимание уделяется исследованию сорбционных свойств местных природных материалов, которые можно использовать для очистки газов и вод различного происхождения. Перспективным является применение природных материалов для сорбционной доочистки сточных вод гальванических производств от катионов Cu2+ [2]. Изучение кинетики сорбции имеет важное практическое и теоретическое значение, так как позволяет установить время достижения равновесия, максимальную рабочую ёмкость и механизм протекания сорбции. В данной работе приведено исследование кинетики сорбции ионов меди (II) материалами естественного происхождения: мергелем, опокой и торфом.
Мергель и опока относятся к цеолитсодержащему сырью. Торф – полидисперсная многокомпонентная система, включающая органическую часть, влагу, минеральные примеси. Исследуемые сорбенты предварительно измельчали и использовали фракцию с размером зёрен 1-2 мм.
Кинетику сорбции изучали методом ограниченного объёма. Для этого в пробирку помещали 0,01 г сорбента и 10 см3 исследуемого раствора с оптимальным значением рН и концентрацией меди 1мкг/см3. Полученную смесь тщательно перемешивали и выдерживали в течение 1, 3, 5, 7, 10, 20 минут. После чего быстро отфильтровывали содержимое каждой пробирки через фильтр «белая лента» на воронке Бюхнера, применяя колбу Бунзена и водоструйный насос. Содержание меди в фильтрате определяли экстракционно-фотометрически диэтилдитиокарбаматом свинца. Для разрушения комплексов меди к фильтрату, полученному после сорбции на торфе, добавляли 20-30 мг персульфата аммония и 0,3 см3 концентрированной соляной кислоты, растворы кипятили в течение 5-7 минут. По разнице массы меди в исходном растворе и растворе после сорбции находили количество меди, переходящее за время экспозиции в фазу сорбента. Интегральные кинетические кривые сорбции ионов меди (II) приведены на рисунке 1.
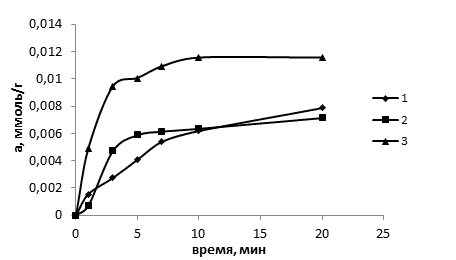
Рис. 1. Интегральные кинетические кривые сорбции ионов Cu2+: 1-опока, 2- мергель, 3-торф
Максимальная степень извлечения достигается за 7 минут при массовом соотношении раствор: сорбент 1000:1, это время можно считать временем установления сорбционного равновесия в системе раствор - сорбент.
Сорбция Cu2+ протекает в смешаннодиффузионном режиме. Известно [3], что для внешнедиффузионных процессов кинетическая кривая должна быть линейной, если представить её в координатах -ln (1-F) – t, где t – время, мин; F - степень достижения равновесия в системе, рассчитываемая как F=At/Ae, где At – количество сорбированного вещества в момент времени t, ммоль/г, Ae – количество сорбированного вещества в состоянии равновесия, ммоль/г. На рисунке 2 видно, что для всех исследуемых сорбентов прямолинейная зависимость в координатах -ln (1-F) – t наблюдается только на начальном этапе сорбции. Это свидетельствует о том, что вначале сорбционный процесс протекает по внешнедиффузионному механизму, а по мере его протекания влияние внешнедиффузионного фактора падает, в внутридиффузионного, наоборот, возрастает [1].
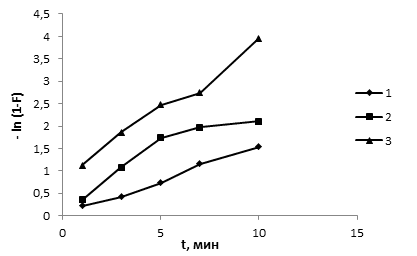
Рис. 2. Зависимость -ln (1-F) от времени для сорбции ионов Cu2+: 1 - опока, 2 – мергель, 3 – торф
Для установления вклада химической реакции в процесс сорбции экспериментальные данные были аппроксимированы в моделях псевдо-первого и псевдо-второго порядка (таблица 1). Линейные формы этих моделей представлены уравнениями (1) и (2) соответственно.
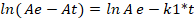 (1)
(1)
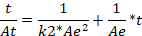 (2)
(2)
где Ае и Аt – количество сорбированного металла на единицу массы сорбента в состоянии равновесия и в момент времени t, ммоль/г; k1 – константа скорости сорбции модели псевдо-первого порядка, мин-1; k2 – константа скорости сорбции модели псевдо-второго порядка, г/ммоль*мин.
Экспериментальные данные лучше всего аппроксимируются в форме уравнения кинетической кривой псевдо-второго порядка (2), следовательно, химическое взаимодействие также оказывает влияние на общую скорость процесса.
Таблица 1
Результаты обработки интегральных кинетических кривых сорбции ионов меди (II) моделями химической кинетики
|
сорбент |
модель псевдо-первого порядка |
модель псевдо-второго порядка | ||
|
k1 |
R2 |
k2 |
R2 | |
|
опока |
0.15 |
0.8835 |
12.56 |
0.9798 |
|
мергель |
0.12 |
0.8347 |
68.03 |
0.9988 |
|
торф |
0.37 |
0.9610 |
75.87 |
0.9979 |
Для опоки константа скорости осаждения ионов Cu2+ из раствора низкая, что связано, в первую очередь, с диффузией, обусловливающей проникновение сорбируемого вещества вглубь структуры сорбента. Мергель имеет более высокую константу скорости за счёт содержания в своей структуре карбонат-ионов. Из исследуемых сорбентов торф имеет самую высокую константу скорости осаждения, что объясняется наличием в его структуре различных функциональных групп и полимолекулярных ассоциатов.
Таким образом, процесс сорбции ионов меди (II) мергелем, опокой и торфом довольно сложен, включает в себя как диффузию, так и химическую составляющую.

.png&w=640&q=75)