Оксигидроксид лантана используется в разных отраслях промышленности: катализаторы, сорбенты, наноматериалы, керамика, люминофоры, лазеры, оптоэлектроника [1].
Во время исследования были изучены продукты гидролиза нитрата лантана, полученные при различных рН и времени введения гидролитического агента равного трём минутам. Использовались методы ТГ-анализа. Обнаружили, что образование оксигидроксида лантана происходит с окклюзией примесных ионов – исходной соли и карбонат-ионов, от углекислого газа, растворенного в воде. Термическое же разложение материала во время гидролиза происходит в четыре этапа. Полученный в результате гидролиза оксигидроксид лантана, нагретый свыше 550°С по сути представляет собой чистый оксигидроксид. Таким образом, pH непосредственно влияет на количество примесей в продуктах гидролиза. В исследуемых образцах минимальное количество примесей было обнаружено при pH синтеза в районе 9,15-9,2 (рис. 1-4). Тем самым для получения наиболее качественного оксигидроксида рекомендуем использовать нитрат лантана и pH равный 9,2.
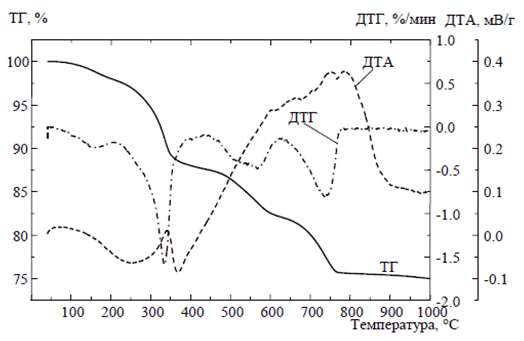
Рис. 1. Термоаналитическая кривая при pH=9,2
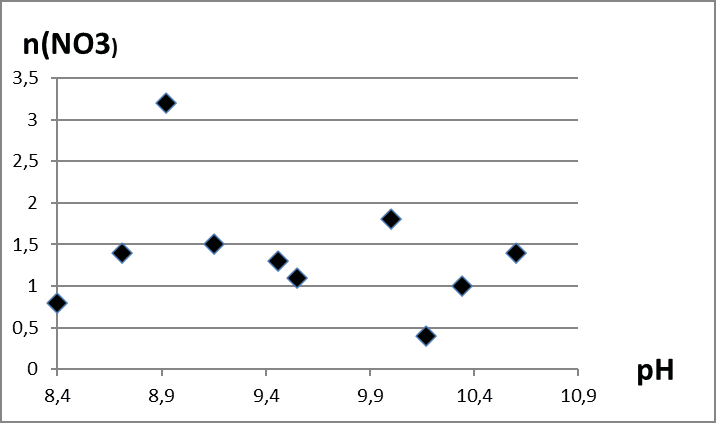
Рис. 2. Зависимость количества нитрат-ионов в оксигидроксиде лантана от pH среды
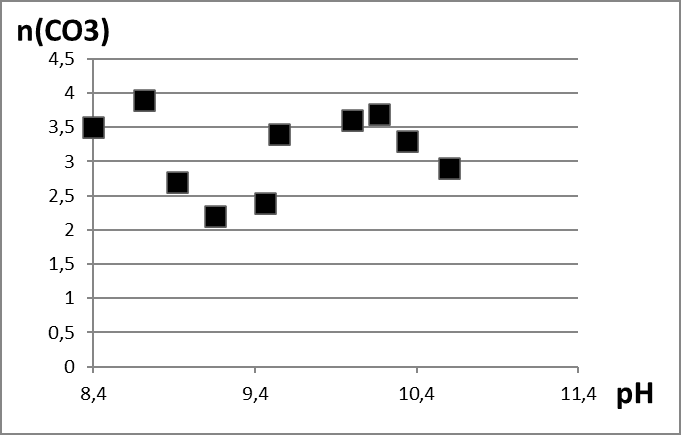
Рис. 3. Зависимость количества карбонат-ионов в оксигидроксиде лантана от pH среды
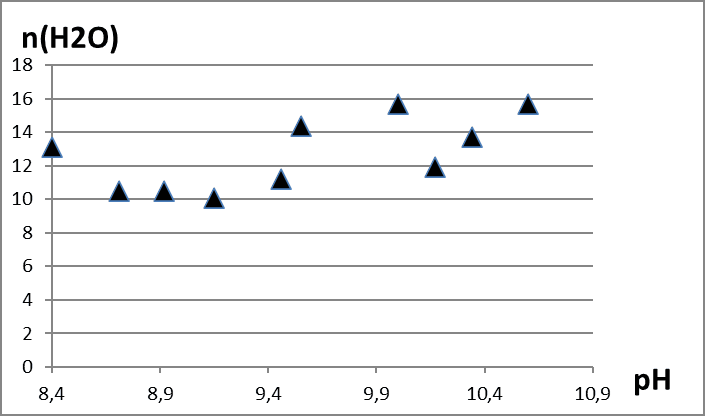
Рис. 4. Зависимость количества молекул воды в оксигидроксиде лантана от pH среды
Таблица
Брутто-состав полученныъ образцов оксигидроксида лантана в пересчёте на 1 моль вещества
|
Номер образца |
Условия |
Брутто-состав |
|---|---|---|
|
01 |
рН=8,40; V=8,4 мл |
La2O3·(H2O)13,1(NO3)0,8(CO3)3,5 |
|
02 |
рН=8,92; V=10,9 мл |
La2O3·(H2O)10,5(NO3)3,2(CO3)2,7 |
|
03 |
рН=9,55; V= 10,3 мл |
La2O3·(H2O)14,4(NO3)1,1(CO3)3,4 |
|
04 |
рН=10,17; V=10,8 мл |
La2O3·(H2O)11,9(NO3)0,4(CO3)3,7 |
|
05 |
рН=10,60; V=10,45 мл |
La2O3·(H2O)15,7(NO3)1,4(CO3)2,9 |
|
06 |
рН=8,71; V=7,4 мл |
La2O3·(H2O)10,5(NO3)1,4(CO3)3,9 |
|
07 |
рН=9,15; V= 10,1 мл |
La2O3·(H2O)10,1(NO3)1,5(CO3)2,2 |
|
08 |
рН=9,46; V=9,8мл |
La2O3·(H2O)11,2(NO3)1,3(CO3)2,4 |
|
09 |
рН=10,0; V=10,5 мл |
La2O3·(H2O)15,7(NO3)1,8(CO3)3,6 |
|
10 |
рН=10,34; V=10,1 мл |
La2O3·(H2O)13,7(NO3)1,0(CO3)3,3 |

.png&w=640&q=75)