Витамин А (ретинол) необходим для поддержания нормального роста и развития, размножения, зрения, иммунитета и нейрогенеза. Кроме этого, ретинол необходим для нормального метаболизма, дифференцировки клеток и роста [6]. Витамин А являясь антиоксидантом, удаляет свободные радикалы, образующиеся в результате окисления липидов, метаболизма и тканей в стрессовых условиях. Усвоение ретинола организмом в некоторой степени зависит от состояния здоровья. Его чрезмерное потребление может вызвать гипервитаминоз с сопутствующими патологиями [1, 7]. В тяжелых случаях токсический статус Витамина А приводит к выпадению волос, патологии костей и аномальным звездчатым клеткам печени. Последствия чрезмерного потребления ретинола до конца не изучены. Как повышенные, так и недостаточные концентрации рассматриваемого витамина могут иметь неблагоприятные последствия для организма. Дефицит Витамина А приводит к нарушению иммунного статуса, развитию ксерофтальмии, включающей спектр от обратимой ночной слепоты до необратимой полной слепоты, повышает смертность. Для оценки статуса Витамина А необходимо контролировать его уровень в печени, так как свыше 85% общего количества ретинола в организме находится в звездчатых клетках данного органа [2].
Для определения концентраций ретинола в биологических образцах используют разные методы, среди которых ВЭЖХ является одним из наиболее предпочтительных. Необходимо учитывать, что содержание витамина А в биологических образцах крайне мало, следовательно, необходимо применение высокочувствительных способов его индикации [3, 4]. При этом для определения ретинола методом ВЭЖХ отдается предпочтение ее градиентным режимам [5, 8].
Цель настоящей работы состоит в разработке способа определения Витамина А в образцах тканей небольшой массы, например, печени сельскохозяйственных животных, с использованием изократичного режима обращено-фазовой ВЭЖХ со спектрофотометрическим детектированием.
Применяли систему ВЭЖХ «Agilent HPLC 1100» (Agilent Technologies, США), оснащенную диодно-матричным детектором «G1315A DAD» (Agilent Technologies, США), управляемой посредством ПЭВМ с использованием программного обеспечения сбора и обработки хроматографических данных «ChemStation» (Agilent Technologies, США). Использовали колонки с обратной фазой: Luna NH2 (250* 4,6 мм), Luna Phenyl-Hexyl (150* 4,6 мм, Phenomenex, США), Zorbax SB-C18, Zorbax SB-C8 (150* 4,6 мм, Agilent, США). Размер частиц сорбента используемых хроматографических колонок 5 мкм. Хроматографический анализ проводили при изократическом элюировании, используя подвижную фазу (ПФ) ацетонитрил-вода (90:10 по объему) при скорости потока, равной 1,0 мл/мин. Детектирование ретинола проводили при длине волны 325 нм по параметрам (времени, мин) его удерживания.
Применяли аналитические весы «A&D HR-250 AZG» (A&D, Корея), гомогенизатор (Ultra-Turrax T25 digital, Великобритания), центрифугу «Centrifuge 5430 R» (Eppendorf, Германия).
Использовали аналитический стандарт ретинола (Sigma Aldrich, США). Градуировочные растворы получали путем разбавления исходного раствора ретинола (1 мг/мл) в абсолютированном этаноле. В ходе анализа применяли гексан «х.ч.», аскорбиновую кислоту (Supelco, США), калия гидроокись «х.ч.», этанол абсолютированный, вода дистиллированная. Объектами исследования являлись биоматериалы – печень сельскохозяйственных животных (куриная, кроличья, свиная, говяжья, конская).
Пробоподготовку биоматериала (печень) осуществляли по схеме, представленной на рисунке 1.
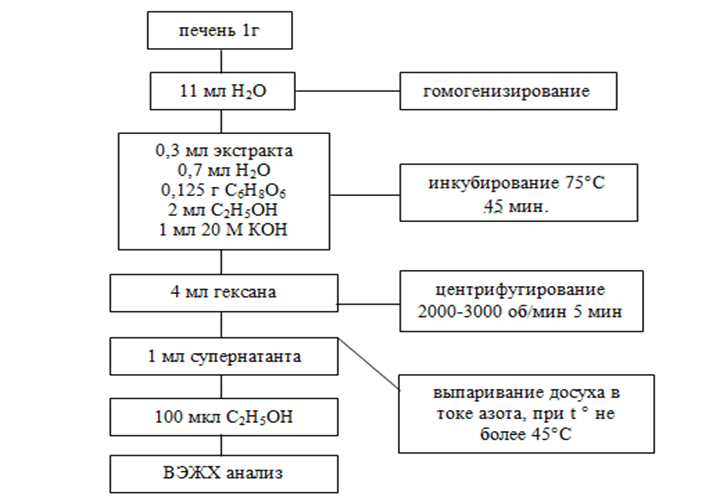
Рис. 1. Схема пробоподготовки
Биологические образцы относятся к объектам, часто исследуемым аналитическими методами с применением ВЭЖХ. Для ВЭЖХ анализа применяли хроматографические колонки с различными неподвижными фазами (НФ). Нами были протестированы сорбенты, содержащие следующие привитые группы: фенил-гексильная, октильная, октадецильная и аминогруппа. При этом при выборе ПФ учитывали, что при хроматографировании масляных растворов, например ретинола ацетата, систему ацетонитрил-вода применять нецелесообразно, вследствие образования эмульсии. При этом были выявлены сложности, связанные:
- с быстрым выходом детектируемого аналита из хроматографической колонки;
- наложением его хроматографического пика на пики несорбируемых колонкой компонентов, содержащихся в исследуемых экстрактах биоматериала;
- искажению формы аналитического сигнала, исследуемого аналита, что приводило к невозможности использования параметров хроматографического пика (высота пика и ширина его основания) для оценки количественного содержания Витамина А.
Сопоставляя данные, полученные при исследовании влияния НФ на эффективность хроматографического разделения, было установлено, что определение Витамина А на колонке с аминогруппой не дает удовлетворительного результата, т.к. были получены сигналы ретинола искаженной формы. Применение хроматографических колонок, содержащих НФ с привитыми алифатическими группами (октильной, октадецильной) и с фенил-гексильной фазой, способствовали устранению ассиметрии хроматографических пиков аналита. Вместе с этим в ходе проведенных экспериментов было также установлено, что применяемые нами различные условия хроматографического разделения не вносят существенный вклад в формирование аналитического сигнала определяемого соединения, которое кроме прочего, хорошо разделяется на приведенных выше НФ с малоудерживаемыми соэкстрагируемыми компонентами биоматрицы. Последнее иллюстрирует рис. 2, на котором представлена ВЭЖХ-хроматограмма стандартного раствора витамина А.
Таким образом, для ВЭЖХ определения могут быть использованы НФ на основе сорбентов, импрегнированных октильной, октадецильной группами, либо НФ содержащие гексильный линкер, соединяющий фенильную группу с поверхностью силикагеля.
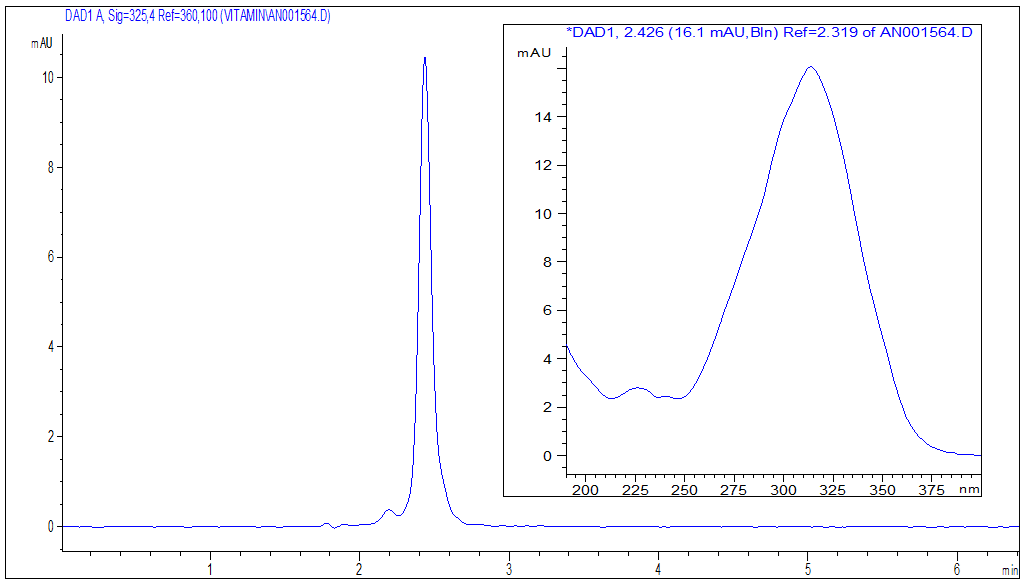
Рис. 2. Хроматограмма стандартного раствора витамина А с применением колонки Luna Phenyl-Hexyl (Phenomenex, США)
Для получения наиболее достоверного результата при исследовании биологических материалов методом ВЭЖХ использовали пробоподготовку, направленную главным образом на осаждение и удаление белковых и липидных фракций.
В качестве осадителя белков при экстракции витамина А применяли этанол, как один из наиболее простых и эффективных реагентов. В качестве антиоксиданта применяли аскорбиновую кислоту. Стадию щелочно-гидролизного омыления проводили раствором КОН различной концентрации (10; 15; 20 и 25 Моль/л). При этом наилучшие результаты были получены при использовании 20 М КОН. Инкубирование проводили при температуре от 60 до 75 °С с шагом 5 °С. Удовлетворительные результаты показала стадия инкубирования при температуре 75 °С.
Результаты исследования печени сельскохозяйственных животных с применением вышеописанного способа определения витамина А представлены в таблице.
Таблица
Результаты определения витамина А в печени животных
|
Найдено Х±∆Х | ||||
|---|---|---|---|---|
|
Печень кроличья |
Печень куриная |
Печень конская |
Печень свиная |
Печень говяжья |
|
3,6±0,04 |
2,9±0,03 |
3,5±0,01 |
4,1±0,03 |
7,3±0,01 |
Таким образом, предложен простой и эффективный способ определения витамина А в биологическом материале методом изократической обращенно-фазовой ВЭЖХ со спектрофометрическим детектированием (325 нм), характеризующийся пределом обнаружения 0,05 мкг/г с простой пробоподготовкой не требующей длительного времени и применения дорогостоящих реактивов.

.png&w=640&q=75)