Интенсивно развивающаяся в настоящее время химия ацетилена и её производных привлекает внимание многих исследователей. Это связано с теми богатыми возможностями разнообразных химических превращений, которые представляют ацетиленовые группировки, обладающие реакционной способностью. Наличие тройной углерод-углеродной связи и подвижного атома водорода способствует реакциям 1,3-диполярного циклоприсоединения диазометана с пропаргиловыми эфирами карбоновых кислот.
В литературе описаны синтезы производных пиразола на основе ацетиленовых и диацетиленовых соединений [1-5]. Однако недостаточно изучены реакции пропаргиловых эфиров карбоновых кислот.
Пропаргиловые эфиры карбоновых кислот были получены реакцией этерификации карбоновых кислот с пропаргиловым спиртом [6, 7]. Синтез производных пиразолов проводили взаимодействием пропаргиловых эфиров карбоновых кислот с диазометаном по схеме:
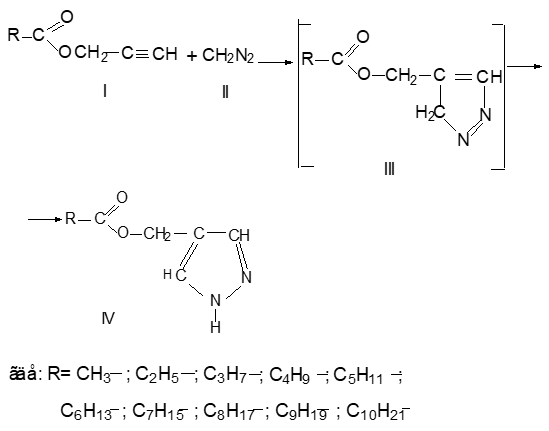
При взаимодействии пропаргиловых эфиров карбоновых кислот с диазометаном вначале образуется неустойчивые гетероциклы (III), которые чаще всего изомеризуется в пиразолы (IV). При этом анион диазометана присоединяется к тройному углеродному атому реагирующей молекулы, т.к. этот атом под влиянием электроноакцепторных заместителей имеет наибольший заряд.
Такого же мнения придерживаются авторы [8, 9]. Они отмечают, что изомеризация наблюдается обычно, если в реакции участвует монозамещенные ацетиленовые соединения.
Полученные соединения представляют собой жидкие вещества со специфическим запахом за исключением 4-(лауриноилоксиметилен)-пиразола, который представляет собой кристаллическое вещество со слабо желтым оттенком.
Выход целевых продуктов составляет 85,6-93,4%.
Структура полученных веществ подтверждается спектральными (ИК-, ПМР) данными.
ИК-спектры всех соединений имеют полосы поглощения, характерных для сложно-эфирной группировки, -СОО-пиразольного кольца NH-группы и др. связей.
Так, в ИК-спектре 4-(бутанолоксиметилен)-пиразола в области 1720 см-1 и 1220 см-1имеются полосы поглощения, характерных для валентных колебаний карбонила и сложно эфирной группировки, полоса же в области 3340 см-1 соответствует валентным колебаниям NH-пиразольного кольца.
В ПМР-спектре пропаргилового эфира масляной кислоты, в области 1,25-2,0 мг имеется метиленовое «возвышение», соответствующее СН2 группе. Метильная группа алифатической цепи характеризуется сигналом при 0,85 мд, сигнал при 4,60 мд характерен для –О-СН2 группы.
Спектр 4-(пропионоиллксиметилен)-пиразолтриплетным сигналом при 0,93 мд относяшийся к концевой метильной группе (а)этильного ряда, синглетом при 4,70 мг характерный для –О-СН2 – группы сигналом протона NH(г) при 5,0 мд и дуплетными сигналами протонов, соответствующих метиновым группам (д.е) пиразольного кольца при 6,12 и 7,4 мд. Величина константа спин-спинового взаимодействия между протонами метиновых групп пиразольного кольца равна 2 герцам свидетельствует о дальнем спин-спиновом взаимодействии через 4 связи.
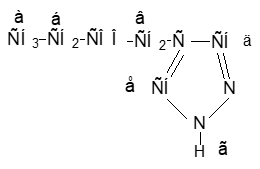
Отношение интегральных интенсивностей обнаруженных сигналов согласуются с числом протонов в соответствующих группах, обусловливающих тот или иной сигнал.
Спектр 4-(бутаноилоксиметил)-пиразол также характеризуется триплетным сигналом при 0,77 мд от 3-х протонов.
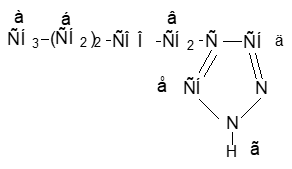
Метильной группы синглетом 4,77мд, характерный для О-СН2 группы, сигналом от 4-х протонов двух метиленовых групп (б) при 2,33 и 1,33 мд, синглетным сигналом протона NH группы (г) при 5,05 мд и дублетными сигналами от протонов соответствующих метиновым группам (д,е) пиразольного кольца при 6,15 и 7,44 мд.
Спектры других производных этого класса соединений, которые отличаются друг от друга алкильной цепью, в целом похожи на приведенные спектры с той лишь разницей, что с увеличением размера алкильной цепи возрастает интенсивность мультиплетных сигналов соответствующей алкильной и наблюдается небольшое смещение сигнала концовой метильной группы в результате все большего удаления ее от электроотрицательной карбоксильной группы.
Таким образом взаимодействие пропаргиловых эфиров карбоновых кислот с диазометаном приводит к 4-(алканоилоксиметилен)-пиразолам.
Состав полученных производных пиразолов подтверждены элементным анализом, структуры доказаны ИК – ПМР-спектроскопией.

.png&w=640&q=75)