Процессы как физической, так и химической адсорбции широко распространены в природе и в течение длительного времени широко используются в медицине, преимущественно для лечения отравлений. Актуальность данной работы обусловлена тем, что адсорбция из растворов на твердых адсорбентах имеет большое практическое значение и широко применяется в медицинской практике для очистки организма от токсичных веществ, для очистки воды и воздуха, в гетерогенном катализе и т.д.
Цель работы: исследовать процесс адсорбции поверхностно-активного вещества из раствора и выявить среди ряда энтеросорбентов различной природы наиболее эффективный адсорбент.
В качестве твердых адсорбентов использовали:
- Активированный уголь – пористый углерод, гидрофобный органический адсорбент, получаемый из древесного или каменного угля.
- Коллоидный диоксид кремния SiO2, который представляет собой легкий белый порошок без запаха.
- Смесь лигнина гидролизного и лактулозы. Лигнин гидролизный – это природный энтеросорбент, состоящий из продуктов гидролиза компонентов древесины. Лигнин не является самостоятельным веществом и с химической точки зрения является условным и обобщенным понятием. Это сложный трехмерный полимер, который имеет сетчатую структуру и ароматическую природу. Принято считать, что молекула лигнина состоит из атомов углерода, кислорода и водорода. Молекула лигнина неопределенно велика и имеет много разнообразных функциональных групп. Общей структурной единицей всех видов лигнина является фенилпропан (C9H10), а различия связаны с разным содержанием функциональных групп. Лактулоза – синтетический дисахарид, молекула которого состоит из остатков галактозы и фруктозы.
В качестве адсорбтива использовали уксусную кислоту (СН3СООН). Это органическая, предельная одноосновная карбоновая кислота.
Исследуемые образцы сорбентов предварительно истирали в фарфоровой ступке до однородного состояния. Размер частиц адсорбентов определяли методом оптической микроскопии: активированный уголь – гранулы размером от 10 до 30 мкм; коллоидный диоксид кремния – аморфные частицы с размером до 900 мкм; смесь лигнина гидролизного и лактулозы – 20 до 60 мкм.
Были приготовлены растворы уксусной кислоты со следующими концентрациями: 0,4 М; 0,3 М; 0,2 М; 0,1 М; 0,05 М. В пять конических колб с пробками внесли по 1 г адсорбента и прилили по 50,0 мл приготовленных растворов уксусной кислоты соответствующих концентраций. Колбы закрыли пробками, поместили на качалку аппарата для встряхивания. Провели процесс адсорбции при встряхивании содержимого в колбах в течение 30 минут. Затем оставили стоять на 30 минут, считая, что за это время установится адсорбционное равновесие. При этом концентрация раствора уксусной кислоты уменьшится за счет адсорбции ее молекул на частицах угля и станет равновесной концентрацией уксусной кислоты. После этого фильтровали растворы уксусной кислоты. Проводили титрование отфильтрованных растворов кислоты 0,1 М раствором гидроксида натрия в присутствии индикатора фенолфталеина. Результаты титрования представлены в табл. 1.
Таблица 1
Результаты титрования растворов уксусной кислоты
|
Сисх, моль/л |
Сравн, моль/л после адсорбции на активированном угле |
Сравн, моль/л после адсорбции на диоксиде кремния |
Сравн, моль/л после адсорбции на смеси лигнина гидролизного и лактулозы |
|---|---|---|---|
|
0,4 |
0,377 |
0,400 |
0,400 |
|
0,3 |
0,278 |
0,300 |
0,292 |
|
0,2 |
0,173 |
0,200 |
0,20 |
|
0,1 |
0,071 |
0,099 |
0,093 |
|
0,05 |
0,020 |
0,0395 |
0,035 |
Величину адсорбции, то есть число моль кислоты, адсорбированной 1 г адсорбента, для каждого объема раствора кислоты рассчитывают по формуле:
Г = (Сисх – Сравн)V/m,
где V – объем кислоты, взятой для адсорбции, л; m – масса угля, г.
Зависимость величины адсорбции Г от Сравн представлена на рис. Величина предельной адсорбции Г∞ является важнейшей характеристикой мономолекулярной адсорбции и представляет собой адсорбцию при предельном заполнении поверхности раствора монослоем адсорбирующегося компонента. Ее можно определить графическим путем. Для этого построили изотермы адсорбции в координатах линейной формы уравнения Ленгмюра Сравн/Г = f(Сравн). Изотерма адсорбции в координатах линейной формы уравнения Ленгмюра получается в виде прямой линии, котангенс угла наклона которой равен Г∞.
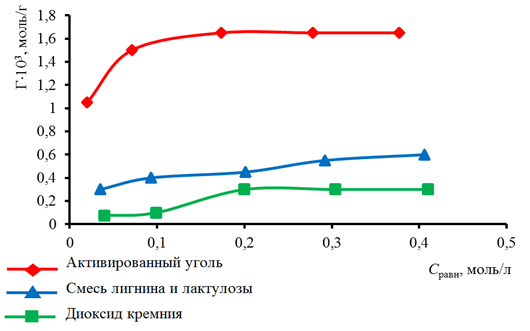
Рис. Изотермы адсорбции на твердых адсорбентах
Рассчитывали величину предельной адсорбции для каждого из исследуемых адсорбентов. Результаты представлены в табл. 2.
Таблица 2
Результаты определения предельной адсорбции
|
Адсорбент |
Г∞, моль/г |
|---|---|
|
Активированный уголь |
1,70×10–3 |
|
Диоксид кремния |
0,44×10–3 |
|
Смесь лигнина гидролизного и лактулозы |
0,66×10–3 |
Очевидно, что величина предельной адсорбции на активированном угле в 4 раза больше данной величины на диоксиде кремния и в 2,5 раза превышает адсорбцию на смеси лигнина и лактулозы.
Предельная адсорбция определяет площадь, занимаемую гидрофильной частью молекул ПАВ, которая не зависит от длины углеводородного радикала, т.е. гидрофобной части молекулы. В нашем случае гидрофильная часть – это карбоксильная группа –СООН. Удельная поверхность – это общая площадь поверхности раздела между твердой и газообразной фазами, приходящаяся на 1 г твердой фазы. Удельная поверхность образована внешней поверхностью всех частиц и внутренней поверхностью открытых пор. Удельную поверхность Sуд можно рассчитать как произведение числа адсорбированных молекул на площадь S0, которую занимает одна молекула адсорбата в насыщенном адсорбционном монослое на границе раздела фаз (табл. 3). Для всех жирных кислот, несмотря на различие углеводородной части, площадь поперечного сечения молекул составляет 0,20 нм2.
Таблица 3
Результаты определения удельной поверхности адсорбентов
|
Адсорбент |
Sуд, м2/г |
|---|---|
|
Активированный уголь |
204,68 |
|
Диоксид кремния |
52,97 |
|
Смесь лигнина гидролизного и лактулозы |
79,46 |
Наибольшим значением удельной поверхности обладает активированный уголь; наименьшим значением – коллоидный диоксид кремния. Промежуточное положение занимает смесь лигнина гидролизного и лактулозы.
Сравнительно меньшую адсорбционную активность диоксида кремния мы связываем с гидрофильностью его поверхности в отличие от гидрофобного угля. Адсорбция заключается в конкуренции между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Известно, что, чем лучше смачивание адсорбента растворителем, тем хуже адсорбция растворенного вещества на его поверхности.
Кроме того, мы полагаем, что во всех случаях наблюдается физический механизм адсорбции. Следует отметить, что с точки зрения эффективности использования сорбента механизм адсорбции не имеет принципиального значения, важен результат того, что адсорбат будет эффективно удерживаться на поверхности адсорбента и тем самым будет минимизирован потенциальный вред от негативного эффекта попадания адсорбтива внутрь организма.

.png&w=640&q=75)