Для формирования правильного подхода к ведению людей с избыточным весом и ожирением необходимо, в первую очередь, понимать, что собой представляет жировая ткань (ЖТ) в человеческом организме и какие функции она выполняет. В анатомии органы определяются как макроскопически разрозненные структуры, которые микроскопически складываются по меньшей мере из двух разных тканей, что взаимодействуют для общих функциональных целей. Жировая ткань как эндокринный орган отвечает этому определению, поскольку он анатомически отделен и складывается из двух типов жировой ткани: белой и бурой. Белая ЖТ распределяется подкожно и висцерально, образуя жировые депо, и превалирует в организме взрослого человека, составляя 15-40% от общей массы тела. В свою очередь, бурая ЖТ –локализуется в шейных, надключичных, паравертебральных, паховых участках и забрюшинном пространстве, на нее приходится лишь 0,1-0,5% массы тела. ЖТ в организме человека выполняет ряд важных функций, обеспечивая термоизоляцию, механическую защиту и хранение энергии. Но одной из наиболее важных и интересных, с клинической точки зрения, является ее эндокринная функция. На рис. 1 показаны органы и системы, на функционирование которых воздействует жировая ткань [1, c. 16-19]:
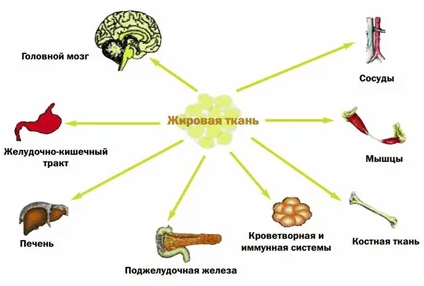
Рис. 1. Органы и системы, на функционирование которых воздействует жировая ткань
Белые и бурые адипоциты выделяют много пептидных гормонов (адипокинов), биоактивных липидов (липокинов) и молекул PHK с локальным (паракринным) и системным (эндокринным) воздействием на мозг, β-клетки поджелудочной железы, печень, скелетные мышцы и сердечно-сосудистую систему. Продукция и секреция адипокинов и липокинов зависит от энергетического статуса жировой ткани. Благодаря эндокринному действию эти факторы способствуют системному энергетическому метаболизму, регулируя аппетит, термогенез, метаболизм глюкозы и липидный обмен. Эндокринные факторы, которые в нормальном состоянии выделяют белая и бурая ЖТ, поддерживают функции органов и метаболический гомеостаз.
При этом клинически значимое воздействие ЖТ на организм обусловлено центральными гормонами жировой ткани, к которым относятся лептин, адипонектин. Регуляция передачи сигналов и реализация биологической функции гормонов ЖТ происходит на разных уровнях, в том числе и на уровне экзосомальной микро-РНК и липокинов. Именно поэтому можно говорить о негативном воздействии избыточного веса и ожирения на функционирование некоторых органов и систем в будущем [2, c. 18]. Подробнее это воздействие показано на рис. 2:

Рис. 2. Риски избыточного веса и ожирения для здоровья человека
При ожирении гипертрофические адипоциты и иммунные клетки, которые содержатся в ЖТ, ускоряют формирование хронического провоспалительного профиля с измененной секрецией адипокинов и липокинов, что сопровождается метаболическим дисбалансом. Избыток ЖТ сопровождается нарушением аппетита, гомеостаза глюкозы, секреции инсулина, функции β-клеток поджелудочной железы и повышение риска развития сахарного диабета 2 типа (СД-2). Все это происходит на фоне неспецифического воспаления, что вызывает ремоделирование сосудов, влияет на сердечно-сосудистую систему и приводит к развитию метаболической жировой болезни печени. Именно поэтому к избыточному весу и ожирению необходимо относиться как к системному хроническому заболеванию, которое требует обязательного лечения, а не как к косметической и эстетической проблеме [3, c. 24-25].
Набор веса вследствие стресса – это не только медико-социальная, но и демографическая проблема, ведь адипокины – важные регуляторы репродуктивной функции в ответ на изменения энергетического баланса. Так, лептин, цилиарный нейротрофический фактор (CNTF) и несфатин усиливают секрецию лютеинизирующего гормона (ЛГ) и подавляют аппетит. Кроме того, лептин повышает тонус симпатической системы и тем самым регулирует функцию адипоцитов. Лептин, адипонектин и фактор некроза опухоли-α (TNF-α) непосредственно влияют на функцию яичников, тогда как ангиопоэтин-образный белок-4, резистин и висфатин регулируют чувствительность к инсулину, гомеостаз глюкозы и липидный обмен. Таким образом, ЖТ является эндокринным органом, который влияет на репродуктивную функцию. Репродуктивная дисфункция при лишнем весе обусловлена сложным многофакторным патогенезом, приводящим к формированию замкнутого круга. Одной из его составляющих является метаболический дисбаланс, который вызывает повышение образования активных форм кислорода и развития оксидативного стресса. Последний становится причиной апоптоза гранулезных клеток, снижению уровня эстрадиола, росту и развитию ооцитов, непосредственно влияющих на качество ооцитов и приводит к негативным последствиям [3, c. 27].
Другой важной составляющей патогенеза указанного состояния является стресс, обусловленный как влиянием внешних факторов (изменения окружающей среды, психоэмоциональное давление, требования, пандемия, война), так и собственно стигмой лишнего веса, сопровождающейся гиперкортизолемией, нарушением поведенческих реакций, связанных с питанием, что еще больше углубляет метаболический дисбаланс.
Говоря о взаимосвязи стресса и набора лишнего веса, нельзя не упомянуть о посттравматическом стрессовом расстройстве (ПТСР), который является острой проблемой в условиях современности. Известно, что ПТСР приводит к ожирению, изменениям в мозге и, предположительно, изменениям уровней гормонов аппетита (лептина, нейропептида Y, грелина, адипонектина, PP). Изменения в мозге, а также изменения уровней гормонов аппетита могут объяснять связь между стрессом и повышением веса, что в итоге приводит к ожирению. В свою очередь, лишний вес приводит к повышению кровяного давления, повышению уровню маркеров воспаления и развития таких сопутствующих заболеваний, как метаболический синдром, СД, сердечно-сосудистые заболевания и нарушение репродуктивной функции [5, c. 44-45].
Факторами, ухудшающими течение стресса и ПТСР, являются диета, семейный анамнез, пол, раса, прием антипсихотиков и наличие сопутствующей психиатрической патологии (депрессия и др.).
Исследование пищевого поведения людей в условиях стресса показали, что лица, которые изначально имеют избыточный вес или массу тела на верхней границе нормы, обычно более склонны к увеличению веса во время стресса, тогда как лица с нормальным и недостаточным весом – нет. В то же время, 70% участников исследований сообщают об увеличении потребления пищи во время стресса, тогда как снижение аппетита наблюдают лишь у 30% [5, c. 49-50].
Во время стресса, независимо от того, увеличивается ли общее потребление калорий, происходит смещение пищевого поведения в сторону потребления «комфортной пищи», к которой относятся сладости, выпечка, пикантные закуски. Это легко объясняется, ведь быстрое всасывание глюкозы из этих продуктов сопровождается выбросом эндорфинов и воспринимается телом как удовольствие. Еще одним фактором, обусловливающим прогрессирование ожирения в условиях стресса, является хронический дефицит ночного сна (<6 ч), который увеличивает склонность к повышению массы тела и адипозопатии с большим содержанием висцерального жира. Подсчитано, что на каждый потерянный час сна повышение IMT может составлять 1,22 кг/м2. Нарушение сна сопровождается такими патогенетическими процессами:
- повышением уровня кортизола;
- сменой центральных и периферических сигнальных путей гормонов голода;
- стимуляцией адипоцитами синтеза провоспалительных цитокинов, поскольку снижение уровня мелатонина автоматически приводит к гиперинсулинемии и уменьшению чувствительности тканей к инсулину;
- снижением уровней гормонов насыщения (лептина), тиреотропного гормона (ТТГ) и адипонектина – мощного противовоспалительного гормона, который образуется из жиров [5, c. 51-52].
Реализация негативного воздействия стресса на организм происходит через ось гипоталамус-гипофиз-надпочечники. Эта регулируемая система представляет собой один из механизмов реагирования организма на острый и хронический стресс. Длительный стресс и/или неадекватная регуляция системы стресса могут привести к хроническому гиперкортицизму или, в некоторых случаях, притуплению реакции кортизола на стресс, способствующей инсулинорезистентности, прогрессированию ожирения и возникновению СД 2 типа.
Более того, острый и хронический стресс через ось гипоталамус-гипофиз-надпочечники и ЦНС может усилить метаболические нарушения, поддерживая воспалительный процесс. ЖТ и воспаление тесно взаимосвязаны, а хроническое воспаление ЖТ приводит к инсулинорезистентности, когда чрезмерное увеличение висцеральной белой ЖТ вызывает каскад биологических процессов, в частности митохондриальную дисфункцию, гипоксию и гибель адипоцитов, что способствует воспалению [3, c. 40].
Таким образом, ученые исследуют взаимосвязь между диетой, образом жизни, стрессом и психическими расстройствами, такими как тревога и депрессия. Реакция «бей или беги» – это врожденная реакция, которая является механизмом выживания. Она позволяет людям быстро реагировать на острый стресс или приспосабливаться к хроническому стрессу. Столкнувшись со стрессом, тело хочет держать мозг наготове. Это снижает уровень некоторых гормонов и химических веществ мозга, чтобы уменьшить поведение, которое не помогает в чрезвычайной ситуации, а также повышает уровень других гормонов. Во время стресса организм снижает уровень нейромедиаторов: серотонина, дофамина и мелатонина.
Серотонин регулирует эмоции, аппетит и пищеварение. Следовательно, его низкий уровень усиливает тревожность и может изменить пищевые привычки человека. Дофамин регулирует целевую мотивацию. Снижение уровня дофамина может привести к снижению мотивации к выполнению физических упражнений, соблюдению здорового образа жизни или выполнению ежедневных бытовых дел. Когда люди испытывают стресс, они также производят меньше гормона сна мелатонина, что приводит к проблемам со сном [2, c. 22].
Адреналин и норадреналин опосредуют физиологические изменения, связанные со стрессом. Их уровень повышается в стрессовых ситуациях. Эти биохимические изменения могут вызвать перепады настроения, повлиять на привычки в еде человека, снизить целенаправленную мотивацию и нарушить циркадный ритм. Следовательно, стресс может вывести из строя пищевые привычки и мотивацию к физическим упражнениям или здоровому питанию. Это объясняет, почему люди наблюдают изменение веса в период стресса [2, c. 23].
Многие люди находят утешение в высококалорийной пище. Шоколад и другие сладости могут сделать человека немного счастливее, повысив уровень серотонина в краткосрочной перспективе. Однако уровень глюкозы в крови очень быстро снижается под воздействием инсулина, поэтому умственный толчок чрезвычайно кратковременен, что заставляет людей есть еще больше. Питание для усиления ощущения комфорта может быть естественной реакцией на стресс, но в сочетании со сниженной мотивацией к физическим упражнениям и потреблением пищи с низким содержанием питательных веществ, стресс может привести к нежелательному увеличению веса.
Мозг связан с кишечником посредством двусторонней системы связи, которая называется блуждающим нервом. Когда человек находится в стрессе, тело тормозит сигналы, которые проходят через блуждающий нерв и замедляет процесс пищеварения. Когда это случается, люди чувствуют сытость [2, c. 23].
Во время стресса надпочечники вырабатывают гормоны стресс-адаптации (норадреналин, адреналин и кортизол).
Кортизол регулирует уровень глюкозы в крови, при этом является главным контринсулярным гормоном, снижает чувствительность клеток к инсулину – равно снижает поступление глюкозы в клетку, угнетает гликолиз. При длительном повышении кортизола, на фоне хронического стресса, формируется гипергликемия (высокий уровень глюкозы в крови) и инсулинорезистентность.
Если организм вырабатывает слишком много кортизола, это приводит к снижению активности гормонов щитовидной железы, что влияет на обмен веществ и выработку энергии. Кроме того, высокий уровень кортизола подавляет чувствительность клеток тела к самому кортизолу и вот это сочетание плохой чувствительности к кортизолу, инсулину и гормонам щитовидной железы приводит к развитию ожирения.
Стресс вреден для нас: он может вызвать нежелательную потерю веса, а также нежелательное увеличение веса, и это может спровоцировать различные проблемы со здоровьем, включая рак, болезни сердца, и, как следствие, раннюю смертность.
Когда человек испытывает стрессовое событие, его гипоталамус, область мозга, будто разжигается. Он сигнализирует о выработке кортизола, цель которого, также состоит в том, чтобы заставить нашу кровь накачать достаточно, и решить - «бить или бежать». Это причина, почему мы так далеко поднялись по эволюционной пищевой цепочке. Но т.к. в современном мире мы не убегаем от саблезубых тигров, когда кортизол начинает качать кровь, это становится причиной многих неприятностей в большей мере, чем эволюционным чудом [4, c. 10-11].
Кортизол стимулирует активность ароматазы в жировых клетках сальника (складка висцерального жира на животе). Ароматаза – это фермент, который конвертирует тестостерон в эстрадиол у обоих полов. При хроническом стрессе речь уже идет о патологических концентрациях ароматазы, это проявляется целым рядом симптомов, которые объединяются под общим термином – синдром доминирования эстрогенов. У женщин это миомы, эндометриоз, болезненные менструации, отечность, набор веса, мигрени. У мужчин тестостерон просто сливается в эстроген, при этом происходит увеличение жировых отложений в области живота и боков, грудь набухает и увеличивается в размерах. Инсулин и кортизол, как правило, антагонисты, но это не касается ароматазы, на нее они действуют синергично, и в условиях метаболического синдрома, когда в крови повышен и уровень инсулина и кортизол – они вдвоем сильно воздействуют на выработку ароматазы.
В иерархии гормонов в организме кортизол вместе с инсулином занимают одно из самых важных значений. Если уровни этих гормонов в пределах нормы – значит и всё остальное благополучно, и наоборот, один за другой будет тянуть обязательно, а дальше, уже каскадом, летят и другие гормоны. Это два базовых гормона. Обеспечить баланс их обоих не просто можно, но и нужно, и, в первую очередь, используя немедикаментозные и даже не нутрициологические инструменты. Это исключительно организационно-бытовые аспекты.
Из-за высокого уровня стресса, в котором мы работаем сегодня, кортизол может стать нашим злейшим врагом. Когда наш мозг запускает стрессовые химические вещества в течение 48 часов и более, это приводит к увеличению веса за счет переедания и увеличения производства жировых клеток в нашем организме.
К счастью, стресс не является неизлечимой болезнью. Но требуются некоторые усилия, чтобы создать значимые изменения, которые помогут телу и мозгу приспособиться к новой ситуации в жизни.
Что можно делать для немедикаментозной коррекции стресса:
- Биоритмы: режим сна (не менее 7-8 часов), режим питания
- Массаж, особенно шейно-воротниковой зоны (можно самостоятельно при помощи массажера, иголочек (аппликатор Кузнецова, Ляпко))
- SPA
- Ароматерапия
- Дыхательные техники
- Йога
- Психотерапия
- Медитация, активная релаксация
- Теплая ванна (с английской солью или с любой другой морской)
- Физические упражнения, растяжка
- Нахождение новых непищевых удовольствий, хобби (танцы, пение, рисование и т.д.)
- Нутритивная поддержка (магний, L-теанин, витамин D, Омега-3, витамины группы В, мелатонин, витамин С)
- Настои из успокаивающих трав и специй
- Помощь другим – это один из лучших способов справиться со стрессом. Люди, работающие волонтерами, после природных катастроф, отмечают повышение оптимизма и прилив энергии. У тех кто пережил природные катастрофы, реже развивается ПТСР, если они сразу же после трагедии начинают помогать другим, то же самое происходит и с жертвами терактов.

.png&w=640&q=75)