1. Введение
На черном рынке запрещенных препаратов новые психоактивные вещества (НПВ) или «дизайнерские наркотики» захватывают все большую популярность. Они представляют собой химические производные или аналоги классических запрещенных препаратов, разработанные для оказания схожего или более мощного эффекта уже известных наркотических средств [1, c. 145]. Даже небольшие модификации в химических структурах этих соединений приводят к появлению различий в биологической активности и фармакокинетических свойствах, а также представляют собой особую проблему для их идентификации в химико-токсикологических лабораториях [2, c. 1186]. Кроме того, психоактивные эффекты фторированных аналогов синтетических каннабиноидов как правило оказывают более сильное воздействие на активность CB1 рецептора, в сравнении с их нефторированными аналогами (в 2-5 раз) [3, c. 445].
Таким образом, появляется необходимость в разработке высокочувствительных и точных аналитических методик, направленных на качественное и количественное определение метаболитов СК [4, c. 11]. СК изначально разрабатывались для исследовательских целей (в том числе для изучения свойств каннабиноидных рецепторов), однако в скором времени стали применятся в увеселительных целях в качестве более мощной альтернативы каннабиса. Для достижения психоактивных эффектов, СК обычно распыляются на высушенные растительные материалы и распространяются как легальная альтернатива марихуаны [7, c. 1109]. СК способны связываться с CB1 и CB2 рецепторами, тем самым вызывая каннабисоподобные эффекты (паранойя, седация, беспокойство, эйфория и нарушение чувство времени) [9, c. 1064; 10, c. 164]. Стоит отметить, что клинические проявления при отравлениях СК частично аналогичны проявлениям, вызываемыми при злоупотреблении амфетаминами [11, c. 534; 12, c. 1167]. Типичные симптомы, проявляющиеся при потреблении СК, включают в себя рвоту, галлюцинации, тахикардию, возбуждение, гипертонию и сонливость [9, c. 1064; 11, c. 534]. Острые отравления СК обычно сопровождаются отеком мозга вследствие гипонатриемии, гипертермии, судорог и серотонинового синдрома [13, c. 973]. СК активно метаболизируют и их основными метаболитами являются гидроксильные или карбоксильные производные ароматического кольца или N-алкильной цепи. Одним из самых популярных СК первого поколения являлся СК JWH-018 [3, c. 445]. В тоже время, к СК второго поколения относятся такие СК, как AB-PINACA, AKB-48 или ADB-PINACA [5, c. 1; 14, c. 444].
В данной работе был исследован новый СК 5F-APINAС (адамантан-1-ил 1-(5-фторпентил)-1Н-индазол-3-карбоксилат), являющийся фторированным аналогом СК APINAС (адамантан-1-ил 1-пентил-1Н-индазол-3-карбоксилат) [5, c. 1]. Включение в пентильную цепь галогена является популярной модификацией, повышающей стабильность, мощность и продолжительность действия СК. Метаболизм APINAС уже был описан ранее [15, c. 45; 16, c. 359]. За счет того, что один из наиболее распространенных путей биотранформации является дефторирование, некоторые метаболиты 5F-APINAC и APINAC имеют структурные сходства с метаболитами 5F-APINACА и APINACА, соответственно [17, c. 199]. Точное определение метаболитов 5F-APINAC, ассоциированных с его употреблением, является необходимым в химико-токсикологическом анализе. Таким образом, целью данной работы являлось in-vitro и in-vivo изучение метаболизма 5F-APINAC с использованием метода жидкостной хроматографии времяпролетной масс-спектрометрии.
2. Материалы и методы
2.1. Химические стандарты и реагенты
Вода высшей степени очистки была получена от компании Biosolve (Валькенываард, Нидерланды); диэтиловый эфир и ацетон в Медхимпром (Москва, Россия); ацетонитрил в Бэкер (Девентер, Нидерланды); метанол и этилацетат из Мерк (Дармштадт, Германия); β-глюкуронидаза из Рош Диагностика (Маннхайм, Германия); 5F-APINAC (чистота ≥ 98%) в Кайман Кемикал (Энн Арбор, США). Остальные реагенты, использованные в исследовании, были получены из Сигма-Олдрич (St. Louis, MO, США); МПЧ были из Корнинг Джентест (Корнинг, НЙ, США); никотинамид аденин динуклеотид фосфат (НАДФН) регенеративной системы состоял из двух реагентов, раствор А (НАДФ+ и глюкоза-6-фосфат), раствор Б (глюкоза-6-фосфат дегидрогеназа) и фосфатного буфера (pH 7.4, 0.5 M) – все из Корнинг Джентест. Твердофазная экстракция проводилась с использованием картриджей Oasis HLB
(60 мг × 3 мл; Вотрес, Милфорд, США).
2.2. Ин-витро исследование
Процесс инкубации проводился в соответствии с протоколом производителя; 20 мкл стандартного раствора 5F-APINAC в этаноле (2 мкМ, конечная концентрация), 50 мкл НАДФН раствора А, 10 мкл раствора Б, 700 мкл деионизированной воды, 200 мкл фосфатного буфера (рН 7.4, 05 М) пемещали в пробирки Эппендорф на 1,7 мл и преинкубировали при 37 ºC в течение 1 часа. Реакцию обрывали добавлением 100 мкл холодного ацетонитрила. Образцы центрифугировали в течение 10 минут при 15000 об/мин для осаждения белка. В полученной смеси выпаривали верхний слой ацетонитрила. Для очистки экстрагированную смесь помещали на ТФЭ картриджи, предварительно кондиционированные 3 мл метанола и 3 мл деионизированной воды. После нанесения образцов картриджи очищали 3 мл деионизированной воды, и далее образцы элюировали 3 мл метанола. Элюэнт выпаривали досуха при 50 ºC под током азота. Остатки перерастворяли в 200 мкл смеси метанол/вода (2:3, л/л) для последующего инструментального анализа.
2.3. Ин-виво исследование
Исследование проводили с использованием крыс мужского пола линии Sprague–Dawley и массой 180-220 г., выдержанных в двухнедельном карантине. Животные были помещены в стандартные пластиковые контейнеры. Крысам из тестовой группы вводили стандарт исследуемого препарата в концентрации 15 мг/кг, растворенный в этаноле или ДМСО, а животным контрольной группы – такой же объем физиологического раствора. После введения препарата, моча отбиралась через 3, 6 и 24 часа после введения. Готовые образцы хранились при -80 ºC вплоть до анализа.
Образцы мочи разделяли на две аликвоты. К 0.5 мл мочи (первая аликвота) добавляли 1 мл 0.8М фосфатного буфера (рН 6.5) с 30 мкл β-глюкуронидазы. После инкубации при 37 ºC в течение 60 минут и доведения рН смеси до 2.0 – 2.5 раствором соляной кислоты, образцы экстрагировали 1 мл этилацетата. Во второй аликвоте этап добавления и инкубации β-глюкуронидазы был пропущен. После выпаривания органического слоя при 70 ºC в твердофазном нагревателе, остаток перерастворяли в 100 мкл смеси метанол/вода (1:1, л/л) для последующего инструментального анализа.
Инструментальный анализ проводился с использованием ВЭЖХ-QTOF-МС/МС системы, состоящей из УВЭЖХ серии Bruker Elute, совмещенным с квадрупольным времяпролетным масс-спектрометром UHRQqTOF maXis impact (Bruker). Разделение аналитов проводилось на хроматографической колонке Intensity Solo 2 1.8 мкм, 100 Ч 2.1 мм (BRU-18C182-100 мкм; Bruker) и предколонке 1.7 мкм ACQUITY UPLC BEH C18 (Waters) при температуре 40 ºC. Мобильная фаза А состояла из 1% метнола в воде, 5мМ формиата аммония и 0.01% муравьиной кислоты. Мобильная фаза В содержала метанол, 5 мМ формиат аммония и 0.01% муравьиную кислоту. Скорость потока была 0.2 мл/мин. Градиентное элюирование проводилось по следующей программе: 0.0–1.0 мин 4% B; 1.0–6.0 мин 50% B; 6.0–10.0 мин 50–99.9% B; 10.0–10.05 мин 99.9–4% B; 10.05–14.0 мин 4% B. Источник электроспрей ионизации (ЭСИ) работал в режиме положительной ионазиации с диапазоном сканирования 30-1000 m/z. Параметры источника были следующими: напряжение на капилляре 4500 В; температура газа-осушителя 220 ºC;скорость потока 8 л/мин; энергия коллизии 7.0 эВ. Общее время анализа составило 20 минут. Поиск метаболитов был основан на определении точной массы иона-прекурсора и типичного иона-продукта в режимах авто и таргет МС/МС.
3. Результаты
При введении исследуемого препарата животным его растворяли в этаноле или ДМСО. На основе проведенных экспериментов, ДМСО не представлялся наилучшим растворителем, так как в данном случае повышался уровень шума в полученных спектрах, что понижало чувствительность определения целевых соединений. Таким образом, результаты ин-виво исследований, описанные в данной статье, основывались на использовании образцов, растворенных в этаноле. Уже через 6 часов после введения препарата было возможно определение большинства метаболитов 5F-APINAC. Однако, через 24 часа следов введения препарата найдено не было, что свидетельствовало об активном метаболизме 5F-APINAC. На рисунке 1 представлена предполагаемая схема метаболизма исследуемого СК.
Пятнадцать метаболитов 5F-APINAC, включая метаболиты второй фазы метаболизма (М8), были тщательно идентифицированы методом ВЭЖХ–QTOF-МС/МС (рисунок 2 и 3). Структуры метаболитов были предсказаны по точной массе и далее подтверждались по фрагментации их ионов-продуктов.
5F-APINAC элюируется на 13,3 минуте, тогда как остальные метаболиты – в диапазоне от 5.1 -12.5 минут. Молекулярный ион 5F-APINAC соответствует m/z 385, с ионом-продуктом m/z 135, соответствующим остатку адамантила, образующимся в результате разрыва эфирной связи (рис.2а). Выявленные метаболиты представляли собой результаты карбоксилирования, гидроксилирования, гидролиза эфирной связи, окисления или глюкуронидирования 5F-APINAC.
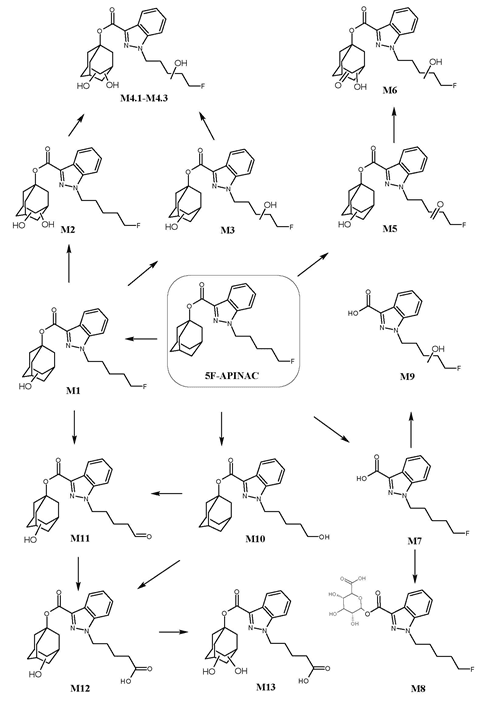
Рис. 1. Схема метаболизма 5F-APINAC
Гидроксилирование являлось наиболее распространенным путем биотрансформации. Выявленные метаболиты можно разделить на следующие группы: метаболиты 1-адамантанола (M1–M6); метаболиты, образованные в результате окислительного детфторированию (M10–M13); и метаболиты N-пентилиндазол-3-карбоновой кислоты (M7–M9).
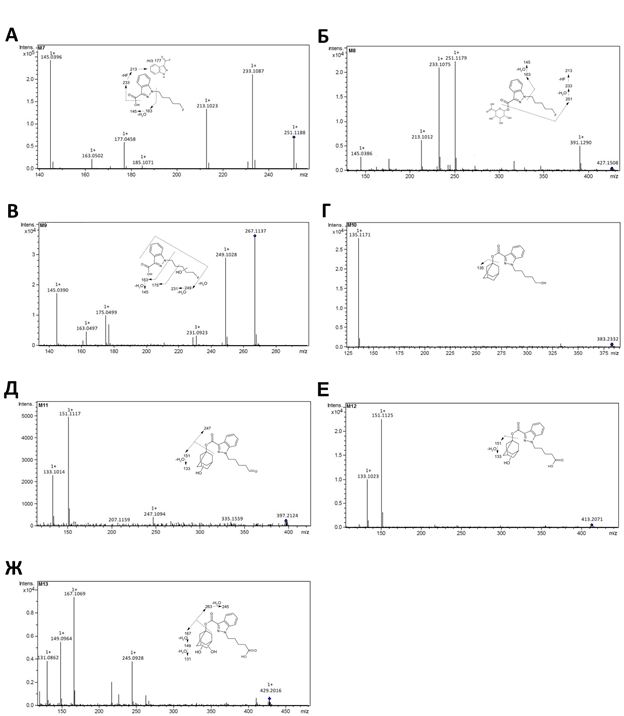
Рис. 2. Спектры продукт-ионов метаболитов 5F-APINAC: А – 5F-APINAC; Б – М1; В – М2; Г – М3; Д – М4.1-М4.3; Е – М5; Ж – М6
3.1. Инкубация 5F-APINAC с микросомами печени человека
5F-APINAC подвергается быстрому гидролизу при инкубации с МПЧ. Исследуемый препарат полностью биотрансформировался через 3 часа после инкубации. Использование НАДФН-зависимой системы приводит к формированию одиннадцати активных метаболитов 5F-APINAC, образованных преимущественно за счет гидроксилирования и окисления исходной молекулы.
3.2. Моногидроксилирование
Метаболит М1, продукт моногидроксилирования 5F-APINAC, образовывался как в ин-витро, так и в ин-виво экспериментах через три часа после введения препарата. Молекулярный ион с m/z 401 элюировался на 10.9 минуте. Ион-продукт с m/z 151 указывал на то, что моногидроксилирование прошло по адамантильному кольцу. Одновременно, ион с m/z 133 указывал на потерю воды из адамантильного кольца (рис. 2б).
3.3. Дигидроксилирование
Метаболиты М2 и М3 представляли собой продукты дигидроксилирования 5F-APINAC. Молекулярный ион соответствовал m/z 417. М2 обнаруживался только в ин-витро эксперименте, тогда как М3 был найден также в эксперименте ин-виво через 6 часов после введения препарата. Относительно М2, обнаруживались два иона-продукта – с m/z 151 и 133. Это соответствовало тому, что моногидроксилирование происходило по адамантильному кольцу. Ион с m/z 267 указывал на присутствие гидроксильной группы на N-фторпентильной цепи, в то время как m/z 249 соответствовал его дегидратированному производному (рис. 2в).
В спектре продукт-ионов М3 содержались фрагменты с m/z 167, 149 и 131, что подтверждало тот факт, что дигидроксилирование шло по адамантильному кольцу. Фрагмент с m/z 167 соответствовал адамантандиолу, тогда как продукт-ионы с m/z 149 и 131 представляли результат последовательной дегидратации фрагмента с m/z 167. В тоже время, продукт-ионы с m/z 251 и m/z 233 подтверждали отсутствие гидроксилирования по N-фторпентильной цепи (рис. 2г).
3.4. Тригидроксилирование
Метаболиты М4.1, М4.2 и М4.3 соответствовали тригидроксильным производным 5F-APINAC. Они детектировались в ин-витро и ин-виво экспериментах вплоть до 6 часов после введения препарата. Молекулярный ион соответствовал m/z 433, а времена удерживания составляли 6.8, 7.7 и 8.2 мин, соответственно. Все три метаболита обладали схожими спектрами, соответствующими тому, что гидроксилирование N-фторпентилиндазольного остатка происходило в трех различных местах, два из которых протекали по адамантилу. Продукт-ионы с m/z 267 и 167 подтверждали разрыв эфирной связи. При этом, фрагмент с m/z 167 соответствовал образованию адамантандиола, тогда как m/z 149 и 131 являлись индикаторами двух последовательных отщеплений воды от фрагмента с m/z 167. Ион с m/z 267 соответствовал 3-карбокси-1-(5-фторгидроксипентил)-1Н-индазолу. Ионы с m/z 249 и 233 указывали на последовательную дегидратацию фрагмента m/z 267 (рис. 2д).
3.5. Моногидроксилирование и окисление
Метаболит М5 был детектирован только в ин-витро эксперименте через 3 часа после начала инкубации. Метаболит элюируется на 8.9 минуте, соответствуя молекулярному иону с m/z 415. Его спектр содержит продукт-ионы с m/z 151 и 133, соответствующими моногидроксилированию адамантильного кольца и потере воды, соответственно (рис. 2е).
3.6. Дигидроксилирование и окисление
Метаболит М6 был обнаружен только в образцах ин-витро и соответствовал m/z 431. Этот метаболит указывал на присутствие карбонильной и гидрокси- групп на адамантильном кольце (m/z 165) и гидроксилирование 5-фторпентильной цепи (m/z 267). Более того, ион с m/z 147 соответствовал потере гидрокси- группы фрагмента с m/z 165 (рис. 2ж).
3.7. Гидролиз эфирной связи
Как было показано ранее, СК, содержащие эфирную связь (например, ВВ-22, РВ-22, 5F-РВ-22, APINAC), подвергаются интенсивному гидролизу [18, c. 88]. Так, метаболит М7 был обнаружен в ин-витро и ин-виво исследованиях через 3 и 6 часов после введения препарата. Более того, он представлял собой наиболее важный метаболит, обнаруженный в моче крыс. Он элюируется на 7.2 минуте и соответствует m/z 251. Ион с m/z 233 соответствовал продукту дегидратации метаболита М7, тогда как m/z 163 и 145 – последовательному сокращению пентильной цепи и дегидратации, соответственно. Потеря фторводорода от m/z 233 приводит к образованию продукт-иона с m/z 213 (рис. 3а).
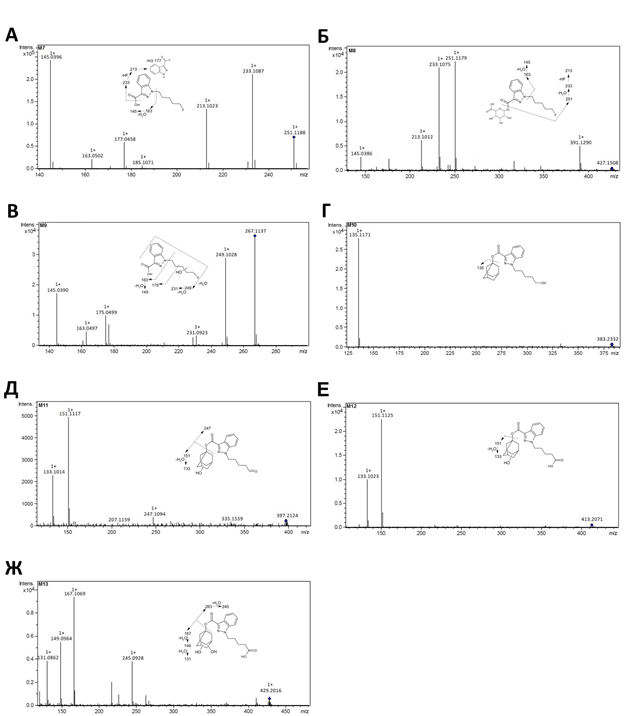
Рис. 3. Спектры продукт-ионов метаболитов 5F-APINAC: А – М7; Б – М8; В – М9; Г – М10; Д – М11; Е – М12; Ж – М13
3.8. Глюкуронидирование
Метаболит М8 являлся продуктом второй фазы метаболизма в эксперименте ин-виво, представляя собой глюкуроновый коньюгат (рис. 3б). Его молекулярный ион имел m/z 427. М8 подвергался частичной фрагментации в источнике ионов, что в результате привело к образованию иона-продукта с m/z 251 (молекулярному иону М7). Последующие продукт-ионы были идентифицированы с m/z 233, 213, 177 и 145.
3.9. Окислительное дефторирование
Метаболит М10 был идентифицирован ин-витро и соответствовал m/z 383, где фтор был замещен на гидроксильную группу (рис. 3г). Фрагмент с m/z 135 указывал на отсутствие модификаций по адамантильном кольцу.
3.10. Окислительное дефторирование и моногидроксилирование
Метаболит М11 (обнаруженный только в ин-витро эксперименте) обладал молекулярным ионом с m/z 397, что соответствовало окислению гидроксильной группы до альдегида и добавлению гидроксильной группы на адамантиле (m/z 151). Фрагмент с m/z 133 соответствовал дегидратации иона с m/z 151, а m/z 247 – разрыву эфирной связи (рис. 4д).
Метаболит М12 был найден в ин-витро и ин-виво экспериментах (молекулярный ион – m/z 413) (рис. 3е). Он соответствовал окислению карбоксильной группы через промежуточное образование альдегида (М11) и формирование гидроксильной группы на адамантиле (m/z 151).
3.11. Окислительное дефторирование (образование карбоксила) и дигидроксилирование
М13 был обнаружен в ин-витро и ин-виво исследованиях через 6 часов после введения препарата. М13 соответствовал молекулярному иону с m/z 429 характерному для замещения фтора на карбоксильную группу и введению двух гидркосильных групп в адамантильное кольцо. Фрагмент с m/z 167 соответствовал адамантандиолу, а ионы с m/z 149 и 131 – указывали на его последовательную дегидратацию. Наименее интенсивные фрагменты с m/z 245 принадлежали фрагментам, соответствующим разрыву эфирной связи (рис. 3ж).
4. Обсуждение
Несмотря на то, что мы не проводили ин-виво исследование 5F-APINAC у человека, использование ин-витро моделей МПЧ совместно с ин-виво экспериментами на крысах является первым шагом для описания метаболизма нового СК. Нефторированный аналог APINAC (AKB-57) является уже хорошо исследованной молекулой, впервые обнаруженной в курительных смесях на черном рынке Австралии и Южной Кореи [15]. В сентябре 2016 года порошковая субстанция (1,97г., 72% чистоты, оцененной методом высокоэффективной хроматографии), содержащая APINAC была конфискована на территории Саратовской области в ходе полицейского расследования [16]. Тем не менее, по нашим данным, APINAC является контролируемым препаратом лишь на территории Японии и республики Беларусь.
Предполагается, что действие фторированного аналога APINAC превосходит APINAC по активности. Так, ранее было описано, что введение галогена в 5-петильной цепи повышает стабильность препарата, силу и продолжительность действия [5, 14].
Стоит отметить, что ин-витро и ин-виво профили метаболитов 5F-APINAC заметно различались. В ин-витро эксперименте наиболее интенсивные пики соответствовали метаболитам М3, М1, М4.3, М2 и М7. Метаболиты М3, М1, М4.3 и М2 наиболее полно отражали цельную структуру 5F-APINAC и подходили в качестве маркеров его потребления в моче, однако, в экспериментах ин-виво метаболит М2 отсутствовал, в то время как интенсивности метаболитов М3, М1 и М4.3 были очень низкими. В ин-виво экспериментах наиболее интенсивными метаболитами являлись метаболиты М7, М8, М13, М4.1, М9 и М4.2 (Интенсивность пика М7 была особенно высокой).
Таким образом, основываясь на проведенных в данной работе экспериментах, М7 является наиболее предпочтительным маркером 5F-APINAC в моче человека, подтверждающим наличие 5-фторпентильной цепи. Помимо этого, для более точного подтверждения присутствия в моче следов 5F-APINAC необходимо обнаружение метаболитов М7, М4.1 и М13.
5. Заключение
В настоящей работе были описаны 15 метаболитов нового синтетического каннабимиметика 5F-APINAC. Точное определение метаболитов проводилось в экспериментах ин-витро на модели МПЧ и ин-виво на моделях крыс. В обоих экспериментах основной реакцией биотрансформации являлся гидролиз эфирной связи, приводящий к формированию метаболита М7 (5-фторпентилиндазол-3-карбоновой кислоты). Другие метаболические превращения включали моно-, ди- и тригидроксилирование адамантильного кольца и N-фторпентилиндазольного остатка, окисление и глюкуронидирование. Изучение данных метаболитов может служить основой для дальнейших исследований, а также основанием для включения выявленных маркеров 5F-APINAC в рутинные скрининговые аналитические методики, применяемые в клинических и химико-токсикологических лабораториях.

.png&w=640&q=75)