Актуальность. Аритмия после инфаркта миокарда (АПИМ) – распространенная клиническая проблема, требующая быстрого выявления и лечения. В эпоху реперфузии частота возникновения аритмии после ИМ снизилась, однако ее наличие может быть связано с увеличением заболеваемости и смертности. В целом аритмии чаще встречаются у пациентов, которым не была проведена своевременная реперфузия, особенно у тех, у которых в результате наблюдалась депрессия фракции выброса левого желудочка (ФВЛЖ). Мы представляем комплексный обзор аритмий после ИМ, включая тахи- и брадиаритмии, включая рекомендуемые методы лечения и ведения. Хотя предшествующая ишемия и связанный с ней рубец миокарда могут оказывать значительное влияние на аритмию, наш обзор фокусируется конкретно на периоде вскоре после ИМ у пациентов как с инфарктом миокарда с подъемом сегмента ST (ИМпST), так и с инфарктом миокарда без подъема сегмента ST (ИМбST)[1, с. 210-271; 2, с. 2869-2876; 3; 4, с. 134-139].
Материалы и методы: был проведен обзор литературы, поключевым словам: инфаркт миокарда; Инфаркт миокарда с подъемом сегмента ST; Инфаркт миокарда без подъема сегмента ST; ускоренный идиовентрикулярный ритм; преждевременные сокращения желудочков в базе данных PubMed, Cyberleninka. Глубина поиска составила 5–10 лет. По ключевым словам, было найдено 154 статьи, из этого списка в наш обзор литературы было включено 16 статей.
Результаты и обсуждение: Желудочковые аритмии. Ускоренный идиовентрикулярный ритм. Ускоренный идиовентрикулярный ритм (УИВР) является распространенной аритмией, наблюдаемой в периинфарктном периоде, и обычно считается маркером реперфузии. До одной трети пациентов с ИМпST будет иметь AIVR. Считается, что этот механизм связан с аномальным автоматизмом в субэндокардиальных волокнах Пуркинье и симпатическими стимулирующими эффектами в пораженной ткани, подвергающейся реперфузии (рис.). Ритм мягкий и самоограничивающийся. Никакого лечения не рекомендуется, поскольку нагрузка обычно снижается в первые дни после ИМ.
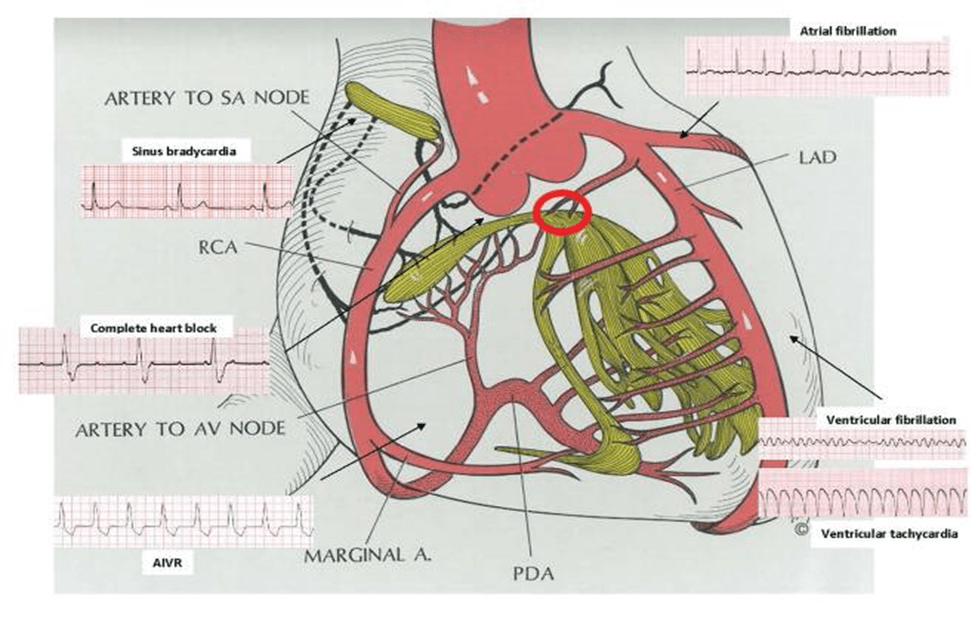
Рис. Анатомия тахи- и бради-аритмий. (Изменено с разрешения: Левайн, Герберт Дж. Клиническая сердечно-сосудистая физиология. 1 апреля 1976 г.)
Преждевременные сокращения желудочков
В периинфарктном периоде желудочковые преждевременные сокращения (ПВС) могут быть маркером электрической нестабильности сердца с потенциалом перерождения в устойчивые желудочковые аритмии (ЖА). ЖЭ уже давно идентифицированы как фактор риска внезапной сердечной смерти (ВСС) после ИМ. [19, с 1 e010004].
Более тридцати лет назад Мухарджи и его коллеги отметили, что частые ЖЭ, определяемые как частота более 10 ЖЭ в час, были связаны со значительно более высокой смертностью в течение 2 лет после ИМ, особенно у лиц со сниженной фракцией выброса .Позже Маджиони и его коллеги оценили данные исследования GruppoItalianoperloStudiodellaSopravvivenzanell’InfartoMiocardico (GISSI-2). Эти результаты повторяют предыдущие исследования: ЖЭ были независимым фактором риска тотальной и внезапной смерти в первые 6 месяцев после острого инфаркта миокарда (ОИМ), особенно у пациентов с частотой ЖЭ более 10 в час и у пациентов со сложной желудочковой экстрасистолией. Признание более высокой смертности у пациентов с ЖЭ после ИМ побудило к проведению серии исследований по подавлению сердечной аритмии (CAST). В совокупности CAST пришел к выводу, что использование антиаритмических препаратов для подавления ЖЭ увеличивает риск смерти, особенно у пациентов со сниженной фракцией выброса. Наконец, в канадском исследовании амиодарона при инфаркте миокарда и аритмии (CAMIAT) пациенты со средним числом 10 или более ЖЭ в час или по крайней мере с одним эпизодом желудочковой тахикардии (ЖТ) после ИМ были рандомизированы на лечение амиодароном или плацебо. Клинически значимое снижение смертности от аритмии и реанимации фибрилляции желудочков (ФЖ) наблюдалось среди пациентов с частыми или повторяющимися ЖЭ, принимавших амиодарон в течение до 2 лет после ИМ, без связанного с этим снижения смертности от всех причин. Принимая во внимание эти данные, амиодарон является разумным антиаритмическим препаратом выбора для пациентов со значительным аритмогенным риском после ИМ, если сравнивать его с риском токсичности. Основой лечения ЖЭ после ИМ остаются бета-блокаторы, которые сглаживают увеличение сложности и частоты ЖЭ без токсичности, связанной с амиодароном.
Неустойчивая желудочковая тахикардия. Неустойчивая желудочковая тахикардия (НСЖТ) обычно определяется как минимум три последовательных тахикардических желудочковых сокращения, прекращающихся менее чем за 30 секунд. Клиническое значение НСЖТ после ИМ остается спорным. Ранние исследования, предполагающие, что НСЖТ связана с худшими исходами, обычно проводились в дореперфузионную эпоху и были сосредоточены на пациентах высокого риска, включая пациентов с ФВЛЖ <40%. Более поздние анализы не подтвердили этот результат/ Действительно, Хонлозер и его коллеги фактически продемонстрировали низкую прогностическую ценность НСЖТ в период вскоре после ИМ для последующей смертности.
Время после ИМ, по-видимому, является наиболее важным фактором, определяющим клиническую значимость НЖТ. Используя данные исследования «Метаболическая эффективность ранолазина для уменьшения ишемии при остром коронарном синдроме без подъема сегмента ST – тромболизис при инфаркте миокарда 36» (MERLIN-TIMI 36), включавшего более 6500 пациентов, госпитализированных с острым коронарным синдромом (ОКС) без подъема сегмента ST, Скирика и его коллеги провели анализ аритмии у 6345 пациентов с первичным исходом ВСС. НСЖТ, возникшая в течение 48 часов после госпитализации по поводу ОКС без подъема сегмента ST, не была связана с увеличением ВСС. Однако эпизоды НСЖТ длятся от 4 до 7 (18,5% против 2,9%, скорректированное ОР 2,3, 95% ДИ от 1,5 до 3,7, p<0,001) или более 8 ударов (6,8% против 4,3%, скорректированное ОР 2,8, 95% ДИ 1,5). до 5,1, p=0,001) в последующем году было связано со значительно более высоким риском ВСС по сравнению с лицами без ЖТ. Этот эффект не зависел от исходных характеристик и ФВЛЖ. Эти результаты, вероятно, отражают механистические различия между ранними и поздними ЖА. НСЖТ во время острой ишемии более вероятен из-за преходящего автоматизма или триггерной активности в области ишемии или инфаркта, по сравнению с поздней НСЖТ, которая более вероятна из-за рубцово-опосредованного ре-энтри желудочка. Основа терапии НСЖТ в период вскоре после ИМ аналогична таковой при ЖЭ и включает бета-блокаторы и, при необходимости, добавление амиодарона или других антиаритмических препаратов.
Желудочковая тахикардия и фибрилляция желудочков. Существует множество сопутствующих и взаимосвязанных процессов, индуцированных ишемией, способствующих желудочковому аритмогенезу в периинфарктном периоде, включая, помимо прочего, усиление автоматизма, гибель клеток и повреждение, генерирующее субстрат для ЖА, а также изменения вегетативного тонуса. Кроме того, некоторые изменения, связанные с ишемией, сохраняются даже в явно зажившем миокарде, что может увеличить риск будущих ЖА в случае рецидива ишемии. Примерно у 6% пациентов, госпитализированных с острым ИМ, развивается ЖТ или ФЖ в течение 48 часов после госпитализации [19: с1 e010004].
Частота ишемических желудочковых тахиаритмий со временем снизилась. При обзоре госпитальной заболеваемости и летальности частота устойчивых ЖА снизилась с Лечение ВА зависит от клинической стабильности. Беспульсовую ЖТ и ФЖ следует лечить в соответствии с рекомендациями по расширенному поддержанию сердечной деятельности для взрослых (ACLS), в частности, немедленную электрическую дефибрилляцию и сердечно-легочную реанимацию. Антиаритмические препараты, такие как амиодарон, могут быть показаны при безуспешных попытках дефибрилляции или при рецидивирующей ЖА [1, c. 210-271; 2, с. 415-418].
В остром периоде внутривенные антиаритмические препараты, такие как амиодарон и лидокаин, могут подавлять нестабильные ишемические ЖА. Агрессивное лечение основных заболеваний, включая ишемию и электролитные нарушения, особенно гипокалиемию и гипомагниемию, имеет решающее значение. Когда ЖТ клинически стабильна, может быть достаточным только антиаритмическое вмешательство. Катетерная абляция ЖА в периинфарктном периоде, как правило, нецелесообразна. Появляются методы подавления вегетативной активности в качестве дополнительного лечения периинфарктных ЖА, включая блокаду звездчатого ганглия [16, c 9:e007118].
Помимо медикаментозной терапии важную роль в лечении ЖА после ИМ играет имплантируемый кардиовертер-дефибриллятор (ИКД). Знаменательные рандомизированные контролируемые исследования 1990-х и начала 2000-х годов продемонстрировали преимущество ИКД по сравнению с медикаментозной терапией, включая антиаритмическую терапию, в группах высокого риска с предшествующим ИМ и сниженной ФВЛЖ, главным образом, за счет профилактики ВСС. Исследователи Многоцентрового исследования имплантации автоматического дефибриллятора (MADIT) и Многоцентрового исследования неустойчивой тахикардии (MUSTT) изучали пациентов с ишемической кардиомиопатией со сниженной функцией левого желудочка <35% и <40% соответственно, с дополнительными критериями у последнего при инвазивном электрофизиологическом исследовании наблюдались НСЖТ и индуцируемая ЖТ. Оба исследования продемонстрировали значительное улучшение выживаемости в группе, получавшей ИКД (MADIT: ОР для общей смертности 0,46; ДИ от 0,26 до 0,82; p=0,009; MUSTT: ОР 0,24 95% ДИ от 0,13 до 0,45; p<0,001). Последующие данные многоцентрового исследования имплантации автоматического дефибриллятора II (MADIT II) и исследования внезапной сердечной смерти при сердечной недостаточности (SCD-HeFT) дополнительно продемонстрировали улучшение выживаемости у пациентов с ишемической кардиомиопатией и выраженной дисфункцией ЛЖ (ФВ ЛЖ <30% и <35% соответственно) даже при отсутствии ЖА или индуцируемой ЖТ (MADIT II: ОР 0,69, 95% ДИ от 0,51 до 0,93; P=0,016). В когорте с ишемией, включенной в SCD-HeFT, установка ИКД была связана со снижением риска смерти на 21% (ОР 0,79, 97,5% ДИ от 0,60 до 1,04, p=0,05). Несмотря на очевидную общую выгоду, преимущества предотвращения внезапной аритмической смерти не перевешивают риски имплантации устройства в течение 30–40 дней после реваскуляризации, отчасти из-за конкурирующих рисков смерти от механических причин после ИМ [5:735-9].
В исследовании «Дефибриллятор при остром инфаркте миокарда» (DINAMIT) рандомизировали 674 пациента через 6–40 дней после ИМ со сниженной ФВ ЛЖ при использовании ИКД по сравнению с отсутствием ИКД. За время наблюдения до 50% внезапных смертей были вызваны механическими причинами, включая разрыв левого желудочка или острую митральную регургитацию. Между двумя группами не было выявлено различий в смертности (ОР 1,08; 95% ДИ 0,76–1,55, p=0,66). Аналогичные результаты были получены в исследовании Immediate Risk Stratification Improves Survival (IRIS), в котором были рандомизированы 898 пациентов с высоким риском внезапной смерти после ИМ (ФВЛЖ <40 и частота сердечных сокращений ≥90 ударов в минуту на первой доступной ЭКГ и/или NSVT). к раннему использованию ИКД по сравнению с медикаментозной терапией. Разницы в смертности между группами не было (ОР 1,04, 95% ДИ 0,81–1,35, р=0,78). Даже без имплантации устройства, как в случае с носимым дефибриллятором, не наблюдалось никакого снижения смертности в современной популяции высокого риска, получившей раннее лечение, хотя проблемы с соблюдением режима использования устройства могли уменьшить преимущества этого устройства, назначаемого на ранних стадиях постинфарктного периода.
Суправентрикулярные аритмии. Синусовая брадикардия. Синусовая брадикардия может быть вызвана ишемическим повреждением синусового узла или вагусно-опосредованным рефлексом. Синусовая брадикардия может возникнуть у 15–25% пациентов после ОИМ, особенно с поражением нижней стенки, поскольку правая коронарная артерия (ПКА) снабжает СА-узел примерно у 55% людей, а остальные 45% снабжаются левой огибающей артерией. Как правило, синусовая брадикардия, связанная с ОИМ, проходит в течение 24 часов и связана с худшими исходами. Медикаментозное лечение с помощью внутривенного введения атропина или временной кардиостимуляции показано при наличии сопутствующего гемодинамического нарушения. Если синусовая брадикардия сохраняется после непосредственного послеинфарктного периода и связана с гемодинамическими нарушениями или симптомами, показана постоянная электрокардиостимуляция [16, 8:e 382–482].
Хотя рекомендации не рекомендуют конкретные сроки имплантации кардиостимулятора после инфаркта, общепринятым считается период ожидания продолжительностью не менее 72 часов. Кроме того, когда кардиостимулятор показан после инфаркта и пациент в противном случае соответствовал бы критериям для ИКД, но находится в пределах 30–40-дневного периода ожидания, имплантация ИКД является разумной для снижения процедурного воздействия.
Синусовая тахикардия. Синусовая тахикардия возникает у 40% пациентов с ИМ. Это неспецифический признак, который может отражать катехоламинергический всплеск, боль, гемодинамическую компенсацию, действие лекарств или другие факторы. Данные, полученные до реперфузии, позволяют предположить, что персистирующая синусовая тахикардия может отражать обширный передний ИМ с пониженной ФВЛЖ, и в этом случае ритм связан с повышенной заболеваемостью, высокой ранней и повышенной 30-дневной смертностью. Важно отметить, что, поскольку синусовая тахикардия может отражать компенсаторный процесс, следует соблюдать осторожность при начале лечения, включая применение бета-блокаторов.
Фибрилляция предсердий/трепетание предсердий. Фибрилляция предсердий встречается у 6–21% больных ИМ. Фибрилляция предсердий, возникающая вскоре после ИМ, обычно является результатом ишемии предсердий, тогда как повышенное давление наполнения и растяжение предсердий способствуют более позднему началу. Факторы риска, связанные с развитием фибрилляции предсердий, включают пожилой возраст, повышенную степень поражения миокарда, симптомы сердечной недостаточности, депрессию функции левого желудочка и многососудистое ишемическое заболевание.
1. Фибрилляция предсердий на фоне ОИМ связана с повышенной смертностью. Обзор Шмитта и его коллег продемонстрировал, что начало после ОИМ является независимым предиктором как внутрибольничной, так и отдаленной смертности. Другое исследование показало, что впервые возникшая фибрилляция предсердий после первичного ЧКВ по поводу острого ИМпST была мощным независимым предиктором большого кровотечения (ОР 1,74, 95% ДИ от 1,30 до 2,34 р = 0,0002) и серьезных неблагоприятных сердечных событий (ОР 1,73, 95% ДИ от 1,27 до 2.36) через 3 года по сравнению с лицами без фибрилляции предсердий. Это увеличение смертности может отражать фибрилляцию предсердий как суррогатный маркер сердечной недостаточности, повышенного давления наполнения и перегрузки объемом после ИМ. Альтернативно, фибрилляция предсердий может вызывать ЖА из-за ишемии, изменения интервалов R-R или активации симпатической нервной системы.Пациенты, у которых после ИМ развивается фибрилляция предсердий, подвергаются более высокому риску инсульта как в больнице, так и при последующем наблюдении , даже если синусовый ритм восстанавливается до выписки. Siu и его коллеги изучили 431 пациента с ОИМ, сохраненной ФВ ЛЖ и транзиторной госпитальной фибрилляцией предсердий со спонтанным переходом в синусовый ритм до выписки из больницы. Эти пациенты были выписаны только на антиагрегантную терапию. Риск последующей фибрилляции предсердий был достоверно выше в группе с транзиторной внутригоспитальной фибрилляцией предсердий (22 против 1,3%, р<0,01), со значительной разницей в риске ишемического инсульта (10,2 против 1,8%, р<0,01) [2, c 2869-2876].
Риск развития фибрилляции предсердий наиболее высок в периинфарктном периоде. В дополнительном исследовании сердечных аритмий и стратификации риска после острого инфаркта миокарда (CARISMA) Джонс и его коллеги наблюдали за имплантируемыми кардиомониторами в популяции из 271 пациента после ИМ с ФВЛЖ<40% без предшествующей фибрилляции предсердий. За 2-летний период фибрилляция предсердий была диагностирована у 39,3% пациентов (95% ДИ 33,7%–45,5) и наиболее вероятна в первые 2 месяца после ОИМ (16%). Ко второму году мониторинга риск развития фибрилляции предсердий приблизился к риску в общей популяции. По сравнению с пациентами без фибрилляции предсердий исследователи дополнительно обнаружили повышенный риск серьезных неблагоприятных сердечных событий у пациентов с фибрилляцией предсердий (ОР 2,73 (95% ДИ от 1,35 до 5,50, р = 0,005)). Важно отметить, что более 90% пациентов с зарегистрированной фибрилляцией предсердий не имели симптомов.
2. Лечение зависит от множества клинических факторов. Фибрилляция предсердий, вызывающая нарушение гемодинамики из-за быстрого или медленного желудочкового ответа, требует стандартного ACLS, включая неотложную помощь, кардиоверсия или кардиостимуляция и инфузия антиаритмических препаратов или препаратов для контроля частоты пульса, таких как амиодарон (таблица 1) [1, с. 104-32 ].
3. В противном случае основная терапия следует стандартным стратегиям ведения в сочетании с управлением риском инсульта. Подробное обсуждение антикоагулянтной терапии для профилактики инсульта при фибрилляции предсердий в условиях стандартной двойной антиагрегантной терапии при лечении ОКС выходит за рамки данного обзора. В целом, более поздние данные показали многообещающие результаты короткого курса тройной терапии (от 1 недели до 1 месяца) с последующим применением однократной антитромбоцитарной терапии пероральным антикоагулянтом прямого действия (ПОАК) или антагонистом витамина К для пациентов. которым показана терапевтическая антикоагулянтная терапия для профилактики инсульта, особенно при уже существующей фибрилляции предсердий . [9, c 629-58; 6, c 16:1513-24].
Атриовентрикулярная блокада высокой степени. Атриовентрикулярная блокада высокой степени (включая АВ-блокаду второй степени 2-го типа и полную блокаду сердца) является редким осложнением ОИМ, возникающим менее чем у 5% пациентов в эпоху реперфузии [6-15, с 10:1598-603].
Реперфузия привела к резкому снижению частоты возникновения АВ-блокады высокой степени, осложняющей ИМпST, с частотой 2% в 2005 г. по сравнению с 5,1% в 1975 г. Пациенты, у которых развивается АВ-блокада высокой степени после ИМ, как правило, старше, имеют более высокие оценки риска Глобального регистра острых коронарных событий (GRACE) и чаще испытывают внутрибольничные осложнения, включая повторный инфаркт миокарда, сердечную недостаточность, кардиогенный шок и ВА. Хотя АВ-блокада высокой степени встречается редко, она связана с высокой заболеваемостью и смертностью. В анализе национальной базы данных выборки стационарных пациентов за 2003–2012 гг. Харикришнан и его коллеги обнаружили, что у пациентов с ИМпST с полной блокадой сердца наблюдалась более высокая внутрибольничная смертность, чем у пациентов без нее (20,4% против 8,7%; скорректированный ОШ: 2,47; 95% ДИ: 2,41-).Ганг и его коллеги, проанализировав данные больничного регистра и Датского национального регистра пациентов, аналогичным образом обнаружили значительно повышенный скорректированный уровень смертности среди пациентов с АВ-блокадой высокой степени по сравнению с пациентами без нее (ОР 3,14, 95% ДИ 2,04-4,84, p< 0,001).
Механизм АВ-блокады высокой степени варьируется в зависимости от анатомии. АВ-узел кровоснабжается дистальными ветвями правой коронарной артерии у 90% больных и из дистальных отделов левой огибающей артерии у 10%. В целом нарушения проводимости, связанные с нижне-задним инфарктом, в первую очередь связаны с ишемией или усилением активности блуждающего нерва на уровне АВ-узла. Таким образом, эти нарушения проводимости имеют тенденцию быть преходящими и поддаются лечению атропином. И наоборот, нарушения проводимости, связанные с передними инфарктами, обычно возникают ниже АВ-узла, предполагают обширный некроз перегородки, с меньшей вероятностью восстанавливаются и могут усугубляться атропином. Таким образом, у пациентов с АВ-блокадой высокой степени в результате переднего ИМ, когда виновником является левая передняя нисходящая артерия, с большей вероятностью потребуется постоянная кардиостимуляция, и они имеют более высокую смертность, чем те, у кого АВ-блокада возникает в результате нижнего ИМ с правой коронарной артерией.
Есть одно заметное исключение из этого общего правила: когда АВ-блокада вследствие нижнего ИМ сопровождается недостаточностью ПЖ и кардиогенным шоком, смертность остается высокой. Большая часть существующих данных о AV-блокаде высокой степени, осложняющей ИМ, получена из когорт пациентов с ИМпST. Однако, согласно обзору данных Национальной выборки стационарных пациентов пациентов с ИМпST и ИМбпST, проведенный Мисумидой и его коллегами, АВ-блокада высокой степени наблюдалась чаще, чем дисфункция синусового узла при ИМпST. Противоположная ситуация наблюдалась в отношении NSTEMI. Исследование также отметило, что пациентам с ИМбпST и АВ-блокадой высокой степени с большей вероятностью потребуется установка постоянного кардиостимулятора, чем пациентам с ИМбпST, что позволяет предположить более низкие показатели спонтанного разрешения в популяции ИМбпST. Несмотря на эти различия, АВ-блокада высокой степени как у пациентов с ИМбпST, так и у пациентов с ИМпST была связана с высокими показателями смертности. Этот результат был повторен в глобальном реестре ОКС, в котором АВ-блокада высокой степени была связана с госпитальной смертью при всех формах ОКС: отношение шансов смерти при наличии и отсутствии АВ-блокады высокой степени было 3,0 для ИМпST ,6,4 для пациентов без ИМпST и 8,2 для нестабильной стенокардии (p<0,001). Первичным лечением пациентов с АВ-блокадой высокой степени, осложняющей ОИМ, является реперфузионная терапия. Для пациентов с симптоматической или гемодинамически значимой АВ-блокадой на фоне ИМ, которая, вероятно, вызвана блокадой АВ-узла, атропин является разумным вмешательством. У нестабильных пациентов можно рассмотреть возможность назначения дофамина и адреналина. Аминофиллин показал многообещающие результаты в небольшой серии случаев, но точные данные отсутствуют. Временная кардиостимуляция показана пациентам с ОИМ со значительной брадикардией или АВ-блокадой, которая не поддается медикаментозному лечению или связана с продолжающимися симптомами.
Как уже отмечалось, AV-проводимость часто восстанавливается после реперфузии и разрешения высокого тонуса блуждающего нерва. В противном случае показана постоянная стимуляция. Когда планируется постоянная кардиостимуляция, можно рассмотреть возможность дефибрилляторной терапии у пациента, которому в противном случае пришлось бы ждать периода реперфузии, чтобы сократить количество процедур и оптимизировать использование ресурсов.
Блок ответвлений пучка (BBB). Новый ГЭБ, осложняющий ОИМ, в эпоху реперфузии встречается редко. Примечательно, что унифасикулярная блокада, особенно левая передняя пучковая блокада, имеет относительно доброкачественный прогноз, в то время как полная блокада правой (ПБП) или левой блокады ножки пучка Гиса (ЛНПБ) связана с более высокой внутрибольничной и долгосрочной смертностью. RBB и дистальная часть передней LBB кровоснабжаются перегородочными перфораторами из LAD. LBB получает двойное питание из дистальных ветвей правой коронарной и проксимальной огибающих сосудов. Как правило, при изолированном ГЭБ, развившемся на фоне ОИМ, не показано никакого лечения, кроме реперфузии. Лево-правая диссинхрония может развиваться на фоне БЛНПГ и быть связана с прогрессирующей дисфункцией ЛЖ и сердечной недостаточностью. В этом случае рассматривается возможность сердечной ресинхронизирующей терапии с применением дефибриллятора или без него.
Выводы. Аритмии после ИМ являются распространенной клинической проблемой. Антиаритмические свойства реперфузии изменили частоту и общие исходы как желудочковых, так и наджелудочковых аритмий при ИМпST и ИМбпST. Повышенная электрическая стабильность инфарктного миокарда при реперфузии оказалась эффективной для уменьшения желудочковых событий ,наджелудочковых аритмий, таких как мерцательная аритмия, и улучшения выживаемости у пациентов с АВ-блокадой высокой степени, осложняющей ОКС. Все эти улучшения, вероятно, связаны с ослаблением ишемического повреждения проводящей системы, снижением риска повторного инфаркта и уменьшением общего размера инфаркта.
В раннем периоде после ИМ существует множество потенциальных аритмических осложнений. Соответствующее лечение часто зависит от влияющих факторов риска, включая время проявления, функцию левого желудочка, клинический статус и сопутствующие заболевания. Некоторые периинфарктные аритмии, включая ЖА, фибрилляцию предсердий и стойкую АВ-блокаду высокой степени, требуют лечения. Другие аритмии, такие как синусовая брадикардия и синусовая тахикардия, а также транзиторная АВ-блокада высокой степени, могут потребовать неотложного лечения, но часто разрешаются с помощью реперфузии и со временем. Во всех случаях способность распознавать эти ритмы, понимать их вероятность и оценивать связанные с ними риски улучшает готовность и, как мы надеемся, результаты для этих уязвимых пациентов.
Таблица
Антиаритмические средства при желудочковых аритмиях после ОИМ
|
Препарат |
Механизм классификации Воана Уильямса |
Интервалы ЭКГ |
Рекомендации |
КОР | ||
|
PR |
QRS |
QT | ||||
|
Дизопирамид Прокаинамид Хинидин |
Класс Ia Замедление деполяризации сердца (фаза 0) с помощью блокады быстрых Na-каналов. Увеличение потенциала сердечного действия и рефрактерного периода, приводящего к замедлению реполяризации с помощью блокады K-каналов (фаза 3). |
- |
↑ |
↑ |
1. Прокаинамид внутривенно может быть полезен для прекращения VT. |
IIa |
|
2. Профилактическое применение прокаинамида после ОИМ ассоциировано с повышенной смертностью. Не рекомендуется. |
- | |||||
|
Лидокаин Мексиатин |
Класс Ib Замедлить деполяризацию сердца (фаза 0) за счет блокады быстрых Na-каналов. Сократить реполяризацию за счет увеличения потенциала покоя фазы 4. |
- |
- |
-/↓ |
1. Внутривенная терапия при рецидивирующей, продолжительной VTA после ОИМ. |
IIa |
|
2. Профилактика лидокаином после ОИМ связана с повышенной смертностью. Не рекомендуется. |
III | |||||
|
Экаинид Флекаинид Пропафенон |
Класс Ic Медленная деполяризация сердца (фаза 0) за счет наиболее мощной блокады быстрых Na-каналов. Значительно снижает сердечный потенциал действия и Скорость проводимости. |
↑ |
↑ |
-/↑ |
Антиаритмические препараты класса IC не рекомендуются пациентам с перенесенным ИМ. 1. Замедление проводимости при применении флекаинида и пропафенона может усугубить желудочковые аритмии после ОИМ. Не рекомендуется. 2. Экаинид и флекаинид повышают риск смертности после ОИМ. Не рекомендуется. |
III |
|
Бета-адреноблокаторы |
Класс II Ингибирование B-адренорецепторов. Уменьшает симпатическое возбуждение, смягчая подъем деполяризации фазы 4, уменьшает возбуждение узла SA. |
-/↑ |
- |
- |
1. Первая строка. Превосходный профиль безопасности и эффективен в снижении ВАШ и ВСС. |
- |
|
2. Бета-адреноблокаторы внутривенного введения могут снижать смертность при полиморфной ЖТ после ИМ. |
IIa | |||||
|
3. Внутривенные бета-адреноблокаторы могут быть эффективны у пациентов с недавним ОИМ с рецидивом ЖТ / ФВ, несмотря на DCCV и использование других антиаритмических препаратов. |
IIa | |||||
|
Амиодарон Дофетилид Дронадерон Ибутилид |
Класс III Блокируйте K-каналы, ответственные за реполяризацию фазы 3, продлевая потенциал сердечного действия. |
-/↑ |
-/↑ |
↑ |
Все они удлиняют QT. Представляют теоретический риск полиморфного ВТ. Риск, вероятно, ниже при приеме амиодарона 1. Амиодарон не рекомендуется для рутинной профилактики ВАШ а. Высокие дозы амиодарона связаны с более высокой смертностью. |
III |
|
b. Умеренная доза амиодарона не превосходит плацебо. |
Я | |||||
|
2. Амиодарон, рекомендованный для применения при остановке сердца вследствие VF или полиморфного VT, невосприимчивого к СЛР, дефибрилляции или вазопрессорной терапии. 3. Нет данных относительно применения дронадерона, ибутилидаилидофетилида. | ||||||
|
Соталол |
1. Для прекращения гемодинамически стабильной ЖТ рекомендуется внутривенное введение амиодарона или соталола. |
МИб | ||||
|
2. Обычно избегают применения у пациентов с прогрессирующей дисфункцией ЛЖ (ФВЛЖ <20%) из-за негативных инотропных эффектов. |
- | |||||
|
Верапамил Дилтиазем |
Класс IV Селективная блокада кальциевых каналов L-типа снижает скорость деполяризации фазы 0, снижает скорость проводимости и увеличивает рефрактерный период AV-узла. |
↑ |
- |
- |
1. Не играет роли в лечении VTA. 2. Внутривенное введение верапамила в условиях продолжительной ЖТ, особенно у пациентов с перенесенным ИМ в анамнезе, было связано с гемодинамическим коллапсом. |
III |

.png&w=640&q=75)