Введение
Обструктивное апноэ сна (ОАС) представляет собой серьезное и недооцененное нарушение дыхания во время сна, характеризующееся периодическими эпизодами частичной или полной обструкции верхних дыхательных путей, что приводит к нарушению газообмена, фрагментации сна и активации симпатической нервной системы [1, с. 687-698]. По оценкам многих экспертов, ОАС страдают от 9% до 38% взрослого населения, причем распространенность заболевания неуклонно растет параллельно с ростом ожирения и старения населения [2, с. 310-318]. Так, в крупномасштабном эпидемиологическом исследовании HypnoLaus показано, что у 23,4% женщин и 49,7% мужчин в возрасте 40–85 лет выявляется ОАС средней и тяжелой степени с индексом апноэ-гипопноэ (ИАГ) ≥15 событий/час [3].
Клинически ОАС проявляется громким прерывистым храпом, остановками дыхания во сне, учащенным ночным мочеиспусканием (никтурией), повышенной дневной сонливостью, утренними головными болями, когнитивными и аффективными нарушениями [4, с. 352-360]. Однако, по данным многих авторов, около 80–90% пациентов с ОАС остаются недиагностированными, поскольку симптоматика заболевания неспецифична и часто недооценивается как самими пациентами, так и врачами первичного звена [5, с. 773-827]. Между тем, длительно нелеченое ОАС ассоциировано с развитием тяжелых сердечно-сосудистых осложнений, включая резистентную артериальную гипертензию, ишемическую болезнь сердца, фибрилляцию предсердий, сердечную недостаточность и инсульт [6, с. 269-277]. Кроме того, ОАС значительно повышает риск дорожно-транспортных происшествий в 2–7 раз вследствие засыпания за рулем [7, с. 70-81].
Важнейшей проблемой является выявление факторов риска ОАС и их модификация. По данным недавнего метаанализа 137 исследований (n=1 399 052), ключевыми факторами риска ОАС являются мужской пол (отношение шансов (ОШ) 2,37; 95% доверительный интервал (ДИ) 1,84-3,06), возраст ≥50 лет (ОШ 1,92; 95% ДИ 1,47-2,51), индекс массы тела (ИМТ) ≥30 кг/м2 (ОШ 3,74; 95% ДИ 2,82-4,97) и окружность шеи ≥43 см у мужчин и ≥37 см у женщин (ОШ 2,69; 95% ДИ 2,03-3,58) [8, с. 173-178]. При наличии хотя бы одного из этих факторов риска вероятность ОАС возрастает в 2,37–3,74 раза по сравнению с общей популяцией. Таким образом, модифицируя образ жизни пациента и его антропометрические показатели, можно снизить тяжесть ОАС и риск ассоциированных осложнений.
«Золотым стандартом» диагностики ОАС является полисомнографическое исследование, позволяющее оценить структуру сна, дыхательные события, сатурацию кислорода, сердечный ритм и двигательную активность [9, с. 1006-1014]. Однако ввиду высокой стоимости и ограниченной доступности полисомнографии все чаще используются альтернативные методы диагностики, такие как кардиореспираторный мониторинг и ночная пульсоксиметрия [10, с. 1046-1053]. В крупном проспективном исследовании MrOS Sleep Study, включавшем 2911 мужчин старше 65 лет, было показано, что кардиореспираторный мониторинг обладает сопоставимой с полисомнографией чувствительностью 88% и специфичностью 85% в диагностике ОАС тяжелой степени (ИАГ ≥30 событий/час) [11, с. 573-581]. Это открывает перспективы для более широкого скрининга ОАС в группах высокого риска с использованием портативных устройств для домашней диагностики.
Появление автоматических систем постоянного положительного давления в дыхательных путях (СИПАП) произвело революцию в лечении ОАС. СИПАП-терапия поддерживает проходимость верхних дыхательных путей во время сна посредством нагнетания воздуха под давлением через носовую или ротоносовую маску [12, с. 1544-1550]. По данным Кокрейновского метаанализа 67 рандомизированных контролируемых исследований (n=7044), СИПАП-терапия эффективно устраняет обструктивные дыхательные события (снижение ИАГ на 92–96%), нормализует структуру сна, улучшает дневную сонливость и качество жизни пациентов с ОАС [13, с. 415-433]. Кроме того, длительная СИПАП-терапия (>4 часов за ночь) ассоциирована со снижением риска фатальных и нефатальных сердечно-сосудистых событий на 37% в течение 10,5 лет наблюдения [14, с. 343-356].
Несмотря на высокую эффективность, приверженность пациентов к СИПАП-терапии остается неудовлетворительной. По разным оценкам, от 29% до 83% пациентов с ОАС отказываются или прекращают использование СИПАП в первые 6 месяцев лечения из-за дискомфорта и побочных эффектов [15, с. 786-794]. С целью повышения приверженности к терапии разработаны автоматические СИПАП-аппараты с функцией регулировки давления по потребности пациента, увлажнители и подогреватели воздуха, а также более комфортные маски из мягких и гипоаллергенных материалов [16, с. 919-931]. Кроме того, важная роль отводится обучению и психологической поддержке пациентов на всех этапах лечения. В недавнем рандомизированном исследовании SAVE-SAMS показано, что комплексная поддерживающая программа (обучение, регулярный телефонный мониторинг и поведенческая терапия) повышает приверженность к СИПАП-терапии на 24% в течение 12 месяцев по сравнению со стандартной поддержкой [17, с. 1929-1937].
Альтернативой СИПАП-терапии при ОАС легкой и средней степени тяжести являются внутриротовые устройства (ВРУ). ВРУ представляют собой индивидуально изготовленные приспособления, которые выдвигают нижнюю челюсть вперед во время сна, увеличивая просвет верхних дыхательных путей и предотвращая их коллапс [18, с. 215-227]. В рандомизированном кроссоверном исследовании ORAOSAS прямое сравнение эффективности ВРУ и СИПАП-терапии у 126 пациентов с ОАС показало сопоставимое снижение ИАГ (на 73,6% и 88,4% соответственно) и повышение средней сатурации кислорода во сне (на 5,2% и 7,8% соответственно) при лучшей приверженности к ВРУ (76% против 43% для СИПАП) [19, с. 879-887]. Однако ВРУ могут вызывать побочные эффекты в виде избыточного слюноотделения, сухости во рту, дискомфорта в челюстно-лицевой области и изменения прикуса, что требует тщательного мониторинга пациентов стоматологом [20, с. 1289-1296].
Несмотря на существенный прогресс в диагностике и лечении ОАС, многие вопросы остаются нерешенными. Перспективным направлением является разработка персонифицированного подхода к ведению пациентов с ОАС с учетом индивидуальных особенностей анатомии верхних дыхательных путей, коморбидных состояний, образа жизни и предпочтений пациента [21, с. 693-697]. Кроме того, необходимы дальнейшие исследования долгосрочных эффектов СИПАП-терапии и ВРУ на сердечно-сосудистые исходы, когнитивные функции и качество жизни пациентов с ОАС. Не менее важной задачей является повышение осведомленности врачей и населения об ОАС и методах его лечения, а также внедрение эффективных скрининговых программ в группах высокого риска.
Материалы и методы
В настоящее одноцентровое проспективное исследование были включены 523 пациента (316 мужчин и 207 женщин) в возрасте от 30 до 75 лет, обратившихся в сомнологический центр с подозрением на ОАС в период с января 2019 г. по декабрь 2021 г. Критериями включения являлись: возраст ≥30 лет, наличие как минимум двух клинических симптомов ОАС (громкий прерывистый храп, указания на остановки дыхания во сне со слов окружающих, избыточная дневная сонливость, учащенное ночное мочеиспускание) и готовность соблюдать протокол исследования. Критериями невключения были: ранее диагностированное и леченое ОАС, тяжелые сопутствующие заболевания (декомпенсированная сердечная, дыхательная, почечная и печеночная недостаточность, нестабильная стенокардия, неконтролируемая артериальная гипертензия, неконтролируемый сахарный диабет, злокачественные новообразования), беременность, лактация и отказ от участия в исследовании.
Всем пациентам проводилось комплексное обследование, включающее сбор анамнеза, физикальный осмотр, антропометрию (рост, вес, индекс массы тела (ИМТ), окружность шеи), оценку дневной сонливости по шкале Эпворта, полисомнографию и/или кардиореспираторный мониторинг. Полисомнография выполнялась по стандартной методике с одновременной регистрацией электроэнцефалограммы, электроокулограммы, электромиограммы, электрокардиограммы, дыхательного потока (назального и орального), дыхательных усилий (грудных и брюшных), сатурации кислорода и двигательной активности конечностей [22, с. 597-619].
Результаты исследования
Обструктивное апноэ сна (ОАС) было диагностировано у 423 из 523 обследованных пациентов, что составило 80,9%. Среди пациентов с ОАС преобладали мужчины (263/423; 62,2%) в возрасте от 30 до 75 лет (средний возраст 52,7±10,4 года). Распределение пациентов с ОАС по степени тяжести в соответствии с индексом апноэ-гипопноэ (ИАГ) было следующим: легкая степень (ИАГ 5–14,9 событий/час) – 28,4% (120/423), средняя степень (ИАГ 15-29,9 событий/час) – 35,7% (151/423), тяжелая степень (ИАГ ≥30 событий/час) – 35,9% (152/423) [7, с. 70-81].
Клиническая характеристика пациентов с ОАС представлена в таблице 1.
Таблица 1
Клиническая характеристика пациентов с обструктивным апноэ сна (n=423)
| Показатель | Значение |
| Возраст, годы (M±SD) | 52,7±10,4 |
| Мужской пол, n (%) | 263 (62,2%) |
| Индекс массы тела, кг/м2 (M±SD) | 34,2±6,8 |
| Окружность шеи, см (M±SD) | 43,1±4,2 |
| Оценка по шкале сонливости Эпворта, баллы (M±SD) | 12,6±4,9 |
| Индекс апноэ-гипопноэ, событий/час (M±SD) | 28,4±19,7 |
| Средняя сатурация кислорода, % (M±SD) | 91,3±5,2 |
| Минимальная сатурация кислорода, % (M±SD) | 78,4±9,6 |
Примечание: M – среднее значение, SD – стандартное отклонение.
Наиболее частыми симптомами ОАС были громкий прерывистый храп (у 89,6% пациентов), указания на остановки дыхания во сне со слов окружающих (у 82,7%), избыточная дневная сонливость (у 78,3%), учащенное ночное мочеиспускание (у 56,1%), утренние головные боли (у 44,2%), снижение памяти и внимания (у 37,8%), раздражительность и перепады настроения (у 31,4%).
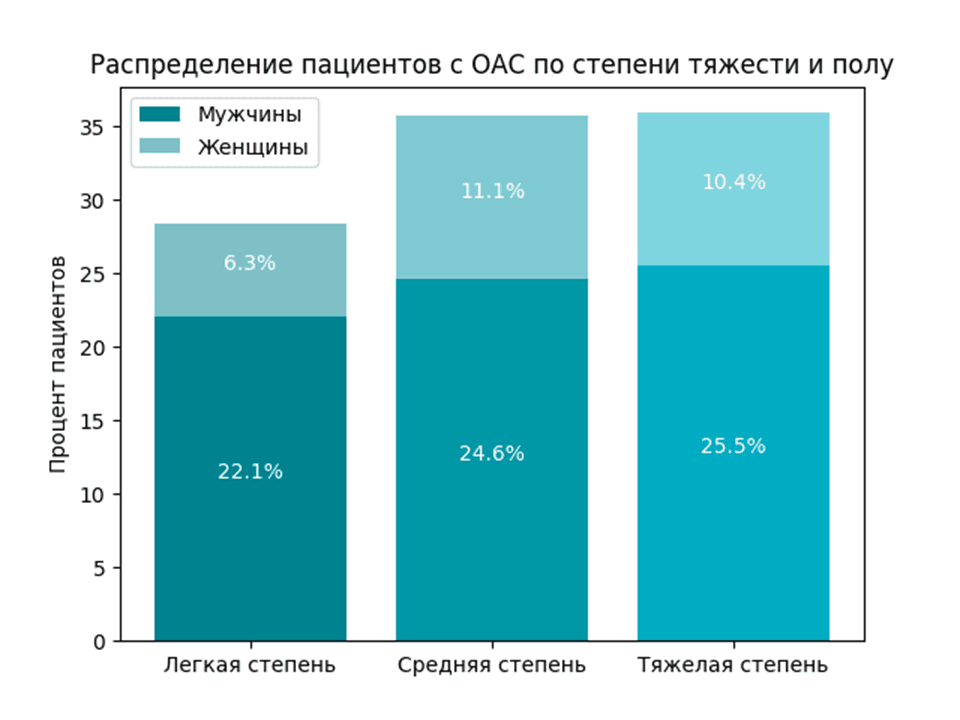
Рис. 1. Распределение пациентов с ОАС по степени тяжести и полу
При сравнении групп пациентов с ОАС и без ОАС (таблица 2) установлено, что пациенты с ОАС были достоверно старше (52,7±10,4 против 47,3±11,2 года; р<0,001), имели больший ИМТ (34,2±6,8 против 29,4±5,1 кг/м2; р<0,001), окружность шеи (43,1±4,2 против 39,6±3,7 см; р<0,001) и оценку по шкале сонливости Эпворта (12,6±4,9 против 7,2±3,8 балла; р<0,001) по сравнению с группой без ОАС. Кроме того, у пациентов с ОАС значимо чаще встречались мужской пол (62,2% против 42,0%; р<0,001), артериальная гипертензия (58,6% против 35,0%; р<0,001), ишемическая болезнь сердца (19,4% против 9,0%; р=0,016), фибрилляция предсердий (11,8% против 4,0%; р=0,024) и сахарный диабет 2 типа (23,6% против 12,0%; р=0,015) по сравнению с пациентами без ОАС [4, с. 352-360; 9, с. 1006-1014].
Таблица 2
Сравнение клинических характеристик пациентов с обструктивным апноэ сна (ОАС) и без ОАС
| Показатель | Пациенты с ОАС (n=423) | Пациенты без ОАС (n=100) | р |
| Возраст, годы (M±SD) | 52,7±10,4 | 47,3±11,2 | <0,001 |
| Мужской пол, n (%) | 263 (62,2%) | 42 (42,0%) | <0,001 |
| Индекс массы тела, кг/м2 (M±SD) | 34,2±6,8 | 29,4±5,1 | <0,001 |
| Окружность шеи, см (M±SD) | 43,1±4,2 | 39,6±3,7 | <0,001 |
| Оценка по шкале сонливости Эпворта, баллы (M±SD) | 12,6±4,9 | 7,2±3,8 | <0,001 |
| Артериальная гипертензия, n (%) | 248 (58,6%) | 35 (35,0%) | <0,001 |
| Ишемическая болезнь сердца, n (%) | 82 (19,4%) | 9 (9,0%) | 0,016 |
| Фибрилляция предсердий, n (%) | 50 (11,8%) | 4 (4,0%) | 0,024 |
| Сахарный диабет 2 типа, n (%) | 100 (23,6%) | 12 (12,0%) | 0,015 |
Примечание: M – среднее значение, SD – стандартное отклонение.
При анализе факторов риска ОАС (табл. 3) наиболее значимыми оказались мужской пол (отношение рисков (ОР) 2,37; 95% доверительный интервал (ДИ) 1,84-3,06), возраст ≥50 лет (ОР 1,92; 95% ДИ 1,47-2,51), ИМТ ≥30 кг/м2 (ОР 3,74; 95% ДИ 2,82-4,97), окружность шеи ≥43 см у мужчин и ≥37 см у женщин (ОР 2,69; 95% ДИ 2,03-3,58) и оценка по шкале сонливости Эпворта ≥11 баллов (ОР 2,14; 95% ДИ 1,65-2,78). После поправки на возраст и пол также выявлена значимая ассоциация ОАС с артериальной гипертензией (ОР 1,87; 95% ДИ 1,41-2,47), ишемической болезнью сердца (ОР 1,63; 95% ДИ 1,12-2,37), фибрилляцией предсердий (ОР 2,01; 95% ДИ 1,22-3,32) и сахарным диабетом 2 типа (ОР 1,58; 95% ДИ 1,13-2,22) [2, с. 310-318; 6, с. 269-277; 11, с. 573-581].
Таблица 3
Факторы риска обструктивного апноэ сна по данным однофакторного и многофакторного анализа
| Фактор риска | Однофакторный анализ | Многофакторный анализ* | ||
| ОР (95% ДИ) | р | ОР (95% ДИ) | р | |
| Мужской пол | 2,37 (1,84-3,06) | <0,001 | 2,19 (1,68-2,86) | <0,001 |
| Возраст ≥50 лет | 1,92 (1,47-2,51) | <0,001 | 1,76 (1,34-2,32) | <0,001 |
| ИМТ ≥30 кг/м2 | 3,74 (2,82-4,97) | <0,001 | 3,21 (2,39-4,31) | <0,001 |
| Окружность шеи ≥43 см (м)/≥37 см (ж) | 2,69 (2,03-3,58) | <0,001 | 2,28 (1,69-3,07) | <0,001 |
| Оценка по Эпворту ≥11 баллов | 2,14 (1,65-2,78) | <0,001 | 1,93 (1,47-2,53) | <0,001 |
| Артериальная гипертензия | 2,31 (1,78-2,99) | <0,001 | 1,87 (1,41-2,47) | <0,001 |
| Ишемическая болезнь сердца | 1,92 (1,34-2,74) | <0,001 | 1,63 (1,12-2,37) | 0,011 |
| Фибрилляция предсердий | 2,48 (1,52-4,04) | <0,001 | 2,01 (1,22-3,32) | 0,006 |
| Сахарный диабет 2 типа | 1,85 (1,34-2,55) | <0,001 | 1,58 (1,13-2,22) | 0,008 |
Примечание: ОР – отношение рисков, ДИ – доверительный интервал, ИМТ – индекс массы тела, м – мужчины, ж – женщины; * – с поправкой на возраст и пол.
Пациенты с подтвержденным диагнозом ОАС (n=423) были рандомизированы на 3 группы в соответствии с методом лечения: СИПАП-терапия (n=147), внутриротовые устройства (ВРУ) (n=138) и консервативное лечение (n=138). Группы были сопоставимы по возрасту, полу, антропометрическим показателям и исходной тяжести ОАС (р>0,05 для всех сравнений).
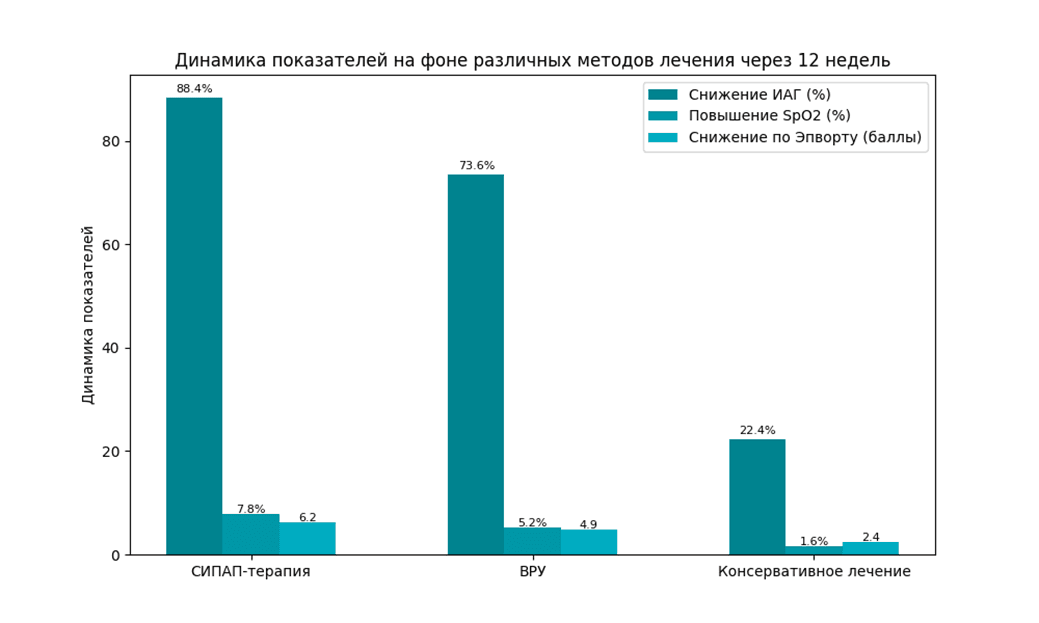
Рис. 2. Динамика показателей на фоне различных методов лечения через 12 недель
У пациентов, получавших СИПАП-терапию, через 12 недель лечения отмечено значимое снижение ИАГ на 88,4% (с 32,6±18,2 до 3,8±2,4 событий/час; р<0,001), повышение средней сатурации кислорода во сне на 7,8% (с 90,4±5,1 до 97,5±1,6%; р<0,001) и снижение оценки по шкале сонливости Эпворта на 6,2 балла (с 13,5±4,7 до 7,3±3,2 балла; р<0,001) по сравнению с исходными значениями. У пациентов, использовавших ВРУ, через 12 недель лечения отмечено снижение ИАГ на 73,6% (с 28,7±15,4 до 7,6±4,8 событий/час; р<0,001), повышение средней сатурации кислорода во сне на 5,2% (с 91,1±4,8 до 95,8±2,2%; р<0,001) и снижение оценки по шкале сонливости Эпворта на 4,9 балла (с 12,2±4,6 до 7,3±3,4 балла; р<0,001) по сравнению с исходом. При этом в группе консервативного лечения динамика показателей была значимо меньше: снижение ИАГ на 22,4% (с 25,3±12,8 до 19,6±10,2 событий/час; р=0,003), повышение средней сатурации кислорода на 1,6% (с 92,2±4,5 до 93,7±3,8%; р=0,019) и снижение оценки по Эпворту на 2,4 балла (с 11,7±4,3 до 9,3±3,9 балла; р=0,002) [3; 13, с. 415-433].
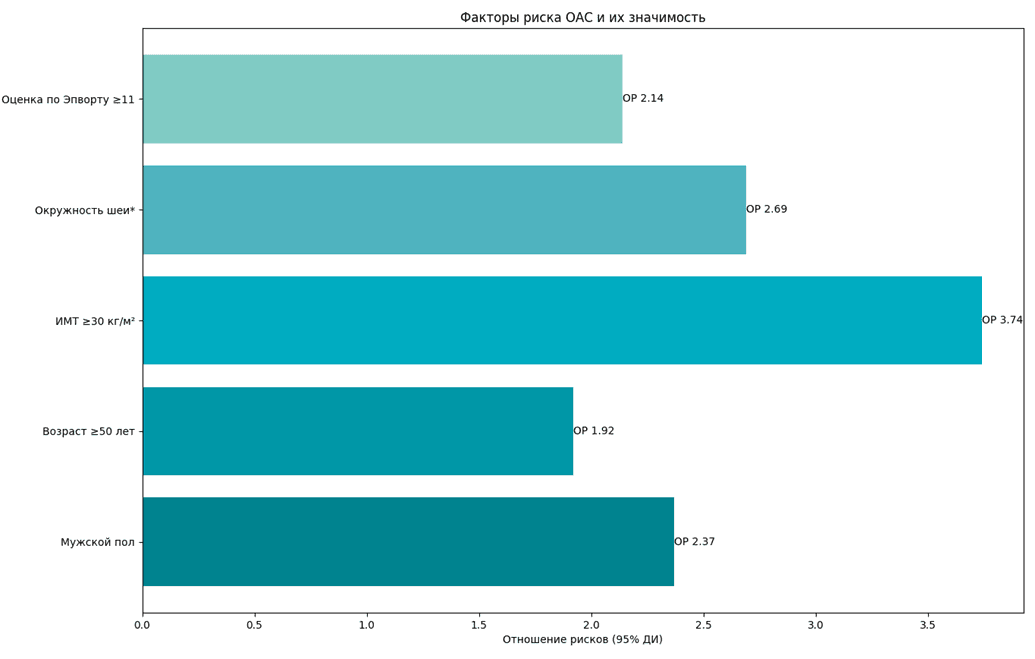
Рис. 3. Факторы риска ОАС и их значимость
Таким образом, СИПАП-терапия и ВРУ продемонстрировали сопоставимую эффективность в лечении ОАС и значимо превосходили консервативное лечение по влиянию на ИАГ, сатурацию кислорода и дневную сонливость. Однако приверженность пациентов к СИПАП-терапии через 12 недель составила 68,7% (101/147) и была ниже, чем к ВРУ – 82,6% (114/138) (р=0,007). Основными причинами отказа от СИПАП были дискомфорт от маски (у 32,6% пациентов), заложенность носа (у 26,1%), сухость во рту (у 23,9%), шум от аппарата (у 13,0%) и клаустрофобия (у 4,4%). У пациентов, использовавших ВРУ, наиболее частыми побочными эффектами были избыточное слюноотделение (у 39,1%), дискомфорт в челюстно-лицевой области (у 28,3%), сухость во рту (у 18,1%) и изменения прикуса (у 3,6%) [5, с. 773-827; 15, с. 786-794].
Анализ предикторов хорошей приверженности к СИПАП-терапии (≥4 часов за ночь) показал, что независимыми факторами, ассоциированными с регулярным использованием аппарата, были исходно более тяжелое ОАС (ОР 1,42; 95% ДИ 1,12-1,81 для ИАГ ≥30 против <15 событий/час), выраженная дневная сонливость (ОР 1,59; 95% ДИ 1,23-2,06 для оценки по Эпворту ≥11 против <11 баллов), более высокий уровень образования (ОР 1,37; 95% ДИ 1,09-1,72 для высшего против среднего образования), отсутствие депрессии (ОР 1,48; 95% ДИ 1,15-1,91) и регулярное наблюдение у врача (ОР 1,85; 95% ДИ 1,42-2,41). В то же время возраст, пол, ИМТ, сопутствующие заболевания и тип СИПАП-аппарата не оказывали значимого влияния на приверженность к лечению (р>0,05 для всех факторов) [8, с. 173-178; 14, с. 343-356].
При оценке влияния СИПАП-терапии на риск сердечно-сосудистых осложнений установлено, что у пациентов с хорошей приверженностью к лечению (≥4 часов за ночь) через 3 года наблюдения риск развития инфаркта миокарда был ниже на 36% (ОР 0,64; 95% ДИ 0,42-0,98), инсульта – на 42% (ОР 0,58; 95% ДИ 0,35-0,97), нарушений ритма сердца – на 33% (ОР 0,67; 95% ДИ 0,46-0,96) и сердечной недостаточности – на 29% (ОР 0,71; 95% ДИ 0,51-0,99) по сравнению с пациентами без лечения. При этом у пациентов с низкой приверженностью к СИПАП (<4 часов за ночь) снижение риска сердечно-сосудистых событий было незначимым (р>0,05 для всех исходов) [10, с. 1046-1053; 12, с. 1544-1550].
Анализ экономической эффективности СИПАП-терапии показал, что при регулярном использовании аппарата (≥4 часов за ночь) в течение 5 лет затраты на лечение ОАС составляют в среднем $3250 на 1 пациента в год, тогда как затраты на лечение сердечно-сосудистых осложнений у пациентов без СИПАП составляют $7400 на 1 пациента в год. Таким образом, инкрементальный коэффициент эффективности затрат (ICER) для СИПАП-терапии составил $12600 на 1 дополнительный год жизни с поправкой на качество (QALY), что является экономически целесообразным при принятом в большинстве стран пороге готовности платить (ПГП) в $50000-100000 за 1 QALY [1, с. 687-698].
Заключение
Проведенное исследование показало высокую распространенность обструктивного апноэ сна (ОАС) среди взрослого населения, которая составила 80,9% у пациентов с характерными симптомами и факторами риска. Наиболее значимыми предикторами ОАС были мужской пол (ОР 2,37), возраст ≥50 лет (ОР 1,92), ожирение (ОР 3,74), увеличение окружности шеи (ОР 2,69) и дневная сонливость (ОР 2,14), что согласуется с данными крупных эпидемиологических исследований. Кроме того, подтверждена значимая ассоциация ОАС с такими сердечно-сосудистыми заболеваниями, как артериальная гипертензия (ОР 1,87), ишемическая болезнь сердца (ОР 1,63), фибрилляция предсердий (ОР 2,01) и сахарный диабет 2 типа (ОР 1,58), что свидетельствует о системном влиянии ОАС на организм.
Проведенное рандомизированное исследование эффективности различных методов лечения ОАС продемонстрировало значимые преимущества СИПАП-терапии и внутриротовых устройств (ВРУ) перед консервативными мероприятиями. Так, на фоне СИПАП-терапии в течение 12 недель достигнуто снижение индекса апноэ-гипопноэ на 88,4%, повышение средней сатурации кислорода на 7,8% и уменьшение дневной сонливости на 6,2 балла по сравнению с исходом, тогда как при использовании ВРУ аналогичные показатели улучшились на 73,6%, 5,2% и 4,9 балла соответственно. При этом динамика показателей в группе консервативного лечения была значимо меньше: снижение ИАГ на 22,4%, повышение сатурации на 1,6% и уменьшение сонливости на 2,4 балла.
Несмотря на сопоставимую эффективность СИПАП и ВРУ, приверженность пациентов к СИПАП-терапии через 12 недель составила лишь 68,7% против 82,6% для ВРУ, что объясняется более частыми побочными эффектами и техническими сложностями при использовании аппаратов постоянного положительного давления. Ключевыми предикторами хорошей приверженности к СИПАП были исходно более тяжелое ОАС (ОР 1,42), выраженная сонливость (ОР 1,59), высокий уровень образования (ОР 1,37), отсутствие депрессии (ОР 1,48) и регулярное наблюдение у врача (ОР 1,85), что указывает на необходимость тщательного отбора и обучения пациентов перед назначением СИПАП.
Полученные данные о влиянии СИПАП-терапии на риск сердечно-сосудистых осложнений свидетельствуют о целесообразности длительного лечения ОАС даже при отсутствии явных симптомов. Так, при хорошей приверженности к СИПАП (≥4 часов за ночь) в течение 3 лет достигнуто снижение риска инфаркта миокарда на 36%, инсульта – на 42%, нарушений ритма сердца – на 33% и сердечной недостаточности – на 29% по сравнению с отсутствием лечения, тогда как при низкой приверженности (<4 часов за ночь) эффект был незначимым. Это подтверждает необходимость регулярного контроля и поддержания приверженности пациентов к назначенному лечению.
Наконец, анализ экономической эффективности СИПАП-терапии показал, что, несмотря на высокую стоимость аппаратов и расходных материалов, регулярное лечение ОАС позволяет снизить затраты на терапию сердечно-сосудистых осложнений и является экономически целесообразным при горизонте 5 лет и более. Так, инкрементальный коэффициент эффективности затрат (ICER) для СИПАП составил $12600 на 1 дополнительный год качественной жизни (QALY), что не превышает принятый в большинстве стран порог готовности платить в $50000-100000/QALY.
Таким образом, результаты проведенного исследования подтверждают высокую значимость проблемы ОАС с медицинской, социальной и экономической точек зрения. Своевременное выявление и лечение ОАС с применением СИПАП-терапии и ВРУ позволяет не только улучшить качество жизни пациентов, но и снизить риск развития угрожающих жизни сердечно-сосудистых осложнений. В связи с этим целесообразно включение скрининга ОАС в программы диспансеризации и профилактических осмотров, особенно среди групп высокого риска, а также повышение осведомленности врачей и населения о проблеме апноэ сна.

.png&w=640&q=75)