Актуальность исследования. Белки признаны основными мишенями для активных форм кислорода (АФК) и азота (АФА) из-за их высокой чувствительности к свободным радикалам [5] и их содержания в биологических материалах [2, 5]. Вторичные продукты, образующиеся в результате оксидативного и/или нитрозативного стресса прямо или косвенно провоцируют накопление окислено-модифицированных белков (ОМБ) [2].
Аминокислоты полипептидной цепи подвергаются множеству преобразований в процессе окислительной модификации. К общим для всех аминокислот преобразований относят образование карбонильных производных (альдегидов и кетонов). Накопление ОМБ служит индикатором при патологических процессах, сопровождающихся свободно-радикальными процессами, а также является важным патогенетическим звеном в развитии нарушений на клеточном уровне. Конечным результатом этого может стать апоптоз или некроз клетки. Существование клетки в аэробных условиях непременно сопровождается накоплением ОМБ, однако не каждая модификация наносит ущерб функционированию белка. Увеличение накопления ОМБ относительно исходного уровня прямо указывает на увеличение скорости патологических процессов.
ОМБ часто приводит к потере активности ферментов, например, в литературе упоминается участие супероксидных анион-радикалов в разрушении железо-серных кластеров аконитазы, которая теряет свою активность после этого [3]. Реакция, катализируемая митохондриальной аконитазой, является важной стадией цикла Кребса, и служит регулятором интенсивности этого процесса в условиях гипоксии, так как эта форма фермента оказывается очень чувствительной к активным формам кислорода, и даже больше, чем цитозольная форма [1, 4]. Очевидно, супероксид, продуцируемый электрон-транспортной цепью митохондрий, участвует в этом процессе. Функционирование цитоплазматической аконитазы связано с регуляцией накопления и утилизации цитрата при липогенезе, а также с синтезом глутамата. Предшественником глутамата является 2-оксоглутарат, который образуется под действием цитоплазматической НАДФ-изоцитратдегидрогеназы из изоцитрата, источником которого является реакция, катализируемая цитозольной формой аконитгидратазы [6, 9].
Инактивация ферментов и торможение метаболических процессов не всегда носит отрицательный характер и может служит механизмом адаптации клетки к изменяющимся условиям. Например, в условиях гипоксии, когда работа электрон-транспортная цепь оказывается невозможной, торможение цикла Кребса необходимо для сохранения баланса окисленных и восстановленных форм коферментов.
Гипоксия является очень распространенным патологическим состоянием, которое влияет на функции всех систем организма, является основной причиной развития инсультов, сердечных приступов и других опасных для жизни состояний. Изучение влияния молекулярных проявлений гипоксии на мужскую репродуктивную систему (эпидидимис) является актуальным, поскольку этот вопрос недостаточно изучен. По этическим соображениям исследование человеческого материала затруднено.
Непосредственная оценка влияние гипоксии на ткани в экспериментах in vivo невозможна, так как в организме во время эксперимента активируются компенсаторные механизмы. Что бы исключить влияния адаптации на уровне целого организма, нами было выбрано изучение свободнорадикальных механизмов повреждения белков при моделировании гипоксии in vitro.
Аконитаза, являясь одной из мишеней действия свободных радикалов, может служить индикатором интенсивности свободно-радикальных процессов (СРП). Для коррекции патологического состояния часто используют дополнительные субстраты, например, препараты сукцината, который является субстратом цикла трикарбоновых кислот. Они широко используются в медицине в качестве биологически активных добавок и не оказывают токсического действия, поскольку являются естественными метаболитами нашего организма.
Цель исследования: изучить влияние экзогенного сукцината на интенсивность свободно-радикальных процессов в тканях эпидидимиса в условиях гипоксии in vitro, и в условиях гипоксии, и с добавлением сукцината.
Материалы и методы. В исследовании были использованы 32 навески от 16 половозрелых белых крыс самцов линии WISTAR массой 220-270 г. Навески тканей были разделены на четыре группы. 8 навесок тканей использовали для моделирования гипоксии и 8 в качестве группы контроля к ней. Другие 16 навесок использовали для моделирования гипоксии в присутствии сукцината и соответствующий контроль по 8 в группе.
Эвтаназия осуществляли под наркозом (смесь «Золетил 100» и «Ксиланит»). После чего у животных забирали ткани эпидидимиса для биохимического исследования. Ткань очищали, измельчали, помещали в 0,25 молярный раствор сахарозы и гомогенизировали в гомогенизаторе Potter S. Все процедуры проводили при температуре не выше 4 °С.
Инкубацию гомогенатов проводили при 37С° 30 минут. Условия гипоксии создавались покрытием слоем вазелинового масла. Сукцинат добавляли из расчёта 100 мг/кг ткани [7]. Соответствующие контроли повторяли условия, но без добавления вазелинового масла. После инкубации отделяли митохондриальную фракцию методом дифференциального центрифугирования.
Критерием оценки активности СРП служила общая пероксидазная активность (ПОА) («Методика определения пероксидазной активности в тканях и биологических жидкостях», Марсянова Ю.А., Судакова Е.А., Кяримов И.А. ФГБОУ ВО РязГМУ Минздрава России, удостоверение на рационализаторское предложение №1415 от 12.12.2019). Метод основан на определении пероксидазной активности ферментов тканей по реакции окисления бензидина в среде, содержащей пероксид водорода. В присутствии ферментов тканей или биологических жидкостей бензидин окисляется пероксидом водорода с образованием дифенохинондиимина. Конденсация последнего с неокисленной формой бензидина приводит к образованию комплекса сине-зелёного цвета, интенсивность окраски которого определяют при длине волны 545 нм. А также определение активности аконитазы [10]. Метод основан на регистрации повышения уровня цис-аконитата в реакции под действием аконитазы ткани. Определяется спектрофотометрически при длине волны 235 нм.
Критерием повреждения белков служила интенсивность накопления ОМБ [8]. Метод основан на спектрофотометрической регистрации 2,4-динитрофенилгидразонов, образующихся в реакции карбонильных производных аминокислотных остатков белков с 2,4-динитрофенилгидразином.
Для расчётов в каждой пробе определяли концентрацию общего белка по методу Лоури. Статистическую обработку данных проводили с помощью программы StatSoft STATISTICA 12. Уровень различий считали статистически значимым при вероятности ошибки p<0,05
Результаты. Уровень общей пероксидазной активности напрямую зависит от скорости накопления основной формой АФК – перекиси водорода. При гипоксии ПОА оказалась больше, относительно контроля в 2,5 раза (рис.1).
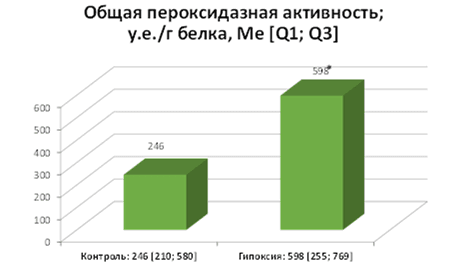
Рис. 1. Изменение общей пероксидазной активности под влиянием гипоксии, p=0,020457 группы сравнения: контрольная и группа, с моделированием гипоксии на гомогенатах ткани
Активность аконитазы достоверно снижается при гипоксии (рис.2). Свободно-радикальные процессы протекают сильнее, и эту закономерность подтверждает накопление окисленно-модифицированных белков (рис. 3).
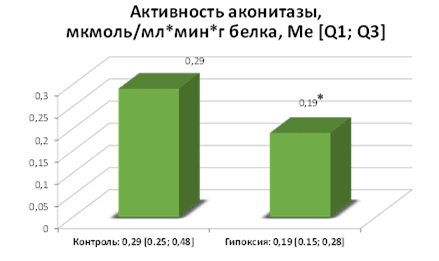
Рис. 2. Изменение активности аконитазы под влиянием гипоксии, p=0,001875 группы сравнения: контрольная и группа, с моделированием гипоксии на гомогенатах ткани
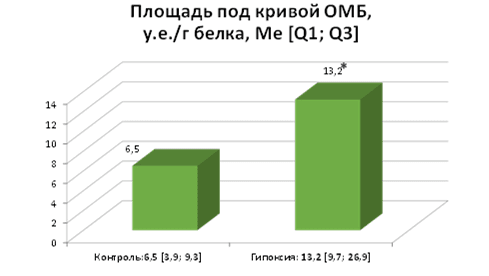
Рис. 3. Изменение окислительной модификации белков под влиянием гипоксии, p=0,003937 группы сравнения: контрольная и группа, с моделированием гипоксии на гомогенатах ткани
О характере изменений в структуре белков можно судить по степени накопления альдегидных и кетоновых производных (рис. 4). Как видно на диаграмме, скорости накопления производных обоих типов примерно одинаковы, так как, несмотря на увеличение их содержания, пропорции содержания меняются незначительно.
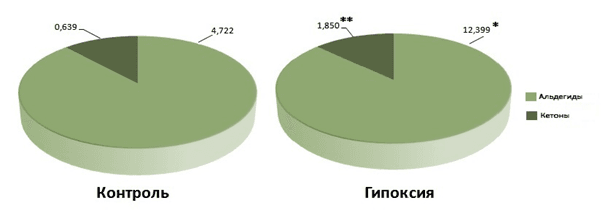
Рис. 4. Изменение содержания альдегид- и кетон- производных при гипоксии, у.е., *р=0,007044, **р=0,013564
В присутствии экзогенного сукцината активность аконитазы не изменилась по сравнению с группой контроля (рис. 5), так же нет достоверных различий в накоплении ОМБ (рис. 6), что указывает на возможное протекторное действие последствий введения сукцината на белки.
Так же нет достоверных различий в накоплении альдегидных и кетоновых производных и изменении из соотношения (рис. 7).
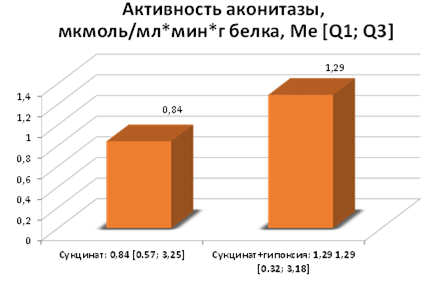
Рис. 5. Изменение активности аконитазы под влиянием сукцината в условиях гипоксии, p=0,282763 группы сравнения: группа с добавлением сукцината к гомогенатам ткани и группа, подвергшаяся гипоксии с добавлением сукцината к гомогенатам ткани
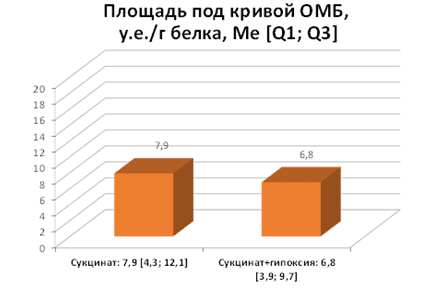
Рис. 6. Изменение окислительной модификации белков под влиянием сукцината в условиях гипоксии, p=0,748699 группы сравнения: группа с добавлением сукцината к гомогенатам ткани и группа, подвергшаяся гипоксии с добавлением сукцината к гомогенатам ткани
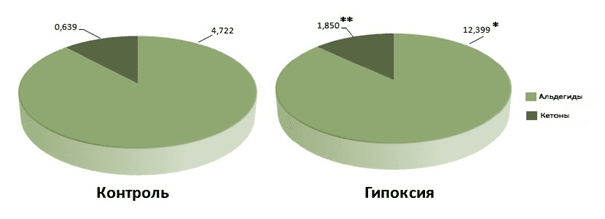
Рис. 7. Изменение содержания альдегид- и кетон- производных под влиянием сукцината в условиях гипоксии, у.е., *р=0,777432, **р=0,72031
Это подтверждается и характером изменений интенсивности свободно-радикальных процессов. Общая ПОА в опытной группе с моделью гипоксии статистически выше относительно контроля в 1,9 раза (рис. 8). Несмотря на повышение СРП в обоих экспериментах, следует отметить, что интенсивность СРП в опыте с гипоксией в присутствии сукцината ниже, чем в опыте с гипоксией. В условиях гипоксии in vitro при условии естественного содержания сукцината возрастает количество АФК вследствие активации комплекса II электрон-транспортной цепи. В условиях гипоксии in vitro и в присутствии экзогенного сукцината обеспечивается однонаправленность потока электронов по ЭТЦ, что является условием более эффективного использования ресурсов клетки и снижения накопления АФК.
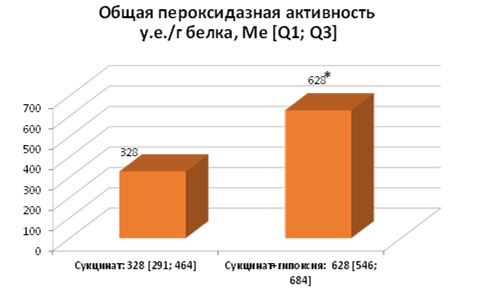
Рис. 8. Изменение общей пероксидазной активности под влиянием сукцината в условиях гипоксии, p=0,000152 группы сравнения: группа с добавлением сукцината к гомогенатам ткани и группа подвершаяся гипоксии с добавлением сукцината к гомогенатам ткани
Выводы. В условиях гипоксии in vitro скорость свободно-радикальных процессов возрастает, что приводит к модификации белковых молекул и изменению активности ферментов. Добавление в среду инкубации экзогенного сукцината в модели гипоксии in vitro так же спровоцировало увеличение интенсивности СРП, но в меньшей степени, результатом чего стало снижение повреждающего действия гипоксии, что подтверждается сохранением уровня ОМБ и активности аконитазы.

.png&w=640&q=75)