Препаративный электрохимический синтез является универсальным методом проведения экологически чистых технологических процессов. По сравнению с обычным химическим синтезом электрохимический подход к утилизации токсичных компонентов углеводородного сырья (а именно, сероводорода) в практически полезные соединения позволяет избегать накопления отходов реагента и поддерживать мягкие условия реакции. В промышленном контексте электросинтез является альтернативным современным технологиям процессом и его отличают высокая экономичность, экологическая безопасность и масштабируемость. Электросинтез относят к так называемым «зеленым» процессам, которые можно контролировать на каждой стадии и в любое время, они исключают неконтролируемые ситуации, поскольку их легко можно остановить [1, 2].
Производные циклогептатриена-1,3,5 привлекают широкое внимание в связи с тем, что они представляют собой лиганды для синтеза различных металлокомплексов с высокой каталитической активностью. Данные соединения относятся к классу структурно «нежестких» и характеризуются внутримолекулярными перестройками с разрывом или образованием связей между алициклом и элементо(металло-)центром. Электрохимические превращения циклогептатриена-1,3,5 изучены в анодной/катодной области и ведут к генерированию радикалов (или ион-радикалов) различной стабильности, которые могут выступать в качестве атакующих частиц в различных химических реакциях [3].
Известно достаточно много способов функционализации ненасыщенных алициклов ввиду их высокой реакционной способности за счет кратных связей. Однако реакционная способность циклогептатриена-1,3,5 несколько отличается от поведения структурных аналогов – циклопентадиена и 1,4-циклогексадиена. Так, при взаимодействии циклогептатриеном-1,3,5 с трифторметансульфонамидом в системе t-BuOCl-NaI протекает его окисление до бензальдегида без образования серосодержащего производного субстрата [4]. В мировой литературе имеется огромное количество публикаций, связанных с изучением каталитических реакций циклоприсоединения к циклооктатетраену-1,3,5. Особенно широко в этих целях используют металлокомплексные катализаторы или каталитические системы на основе солей металлов [5].
Ранее нами широко изучено применение редокс-активации H2S для тиолирования органических соединений при комнатной температуре и атмосферном давлении [6]. Данный подход не использовался до настоящего момента в реакциях H2S с циклогептатриеном-1,3,5, реализуемых в органических средах.
В работе впервые предложен способ утилизации сероводорода в продукты S-функционализации циклогептатриена-1,3,5 с привлечением анодной активации реагента до нестабильного катион-радикала, который фрагментируется с отщеплением протона (схема 1).
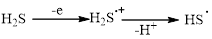 (1)
(1)
При изучении электрохимического поведения циклогептатриена-1,3,5 в СH3CN методом циклической вольтамперометрии (ЦВА) установлено, что данное соединение окисляется при значении потенциала (1,52 В), соизмеримом с потенциалом пика анодного H2S (1,6 В) (рис. 1).
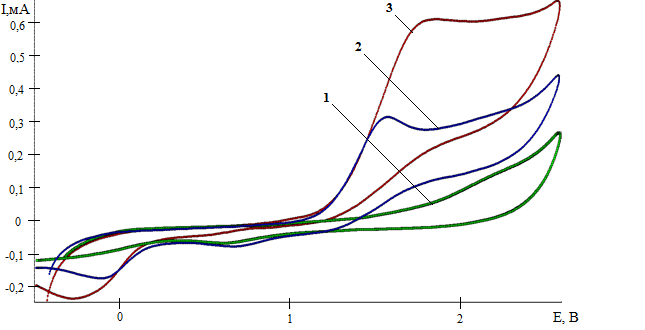
Рис. 1. ЦВА окисления: фонового электролита – 1; циклогептатриена-1,3,5 (С=0,01 М) – 2; циклогептатриена-1,3,5 в присутствии сероводорода (С=0,005 М) – 3
(CH3CN, Pt-анод (d=2 мм), Ag/AgCl, 0,1М n-Bu4NСlO4, ʋ = 0,2 В/с)
Процесс окисления циклогептатриена-1,3,5 является малообратимым, так как коэффициент обратимости (отношение тока пика катодного к току пика анодного) равен 0,37. При увеличении концентрации раствора субстрата в СH3CN наблюдали возрастание по току пика его окисления и смещение значения потенциала в анодную область (рис. 2).
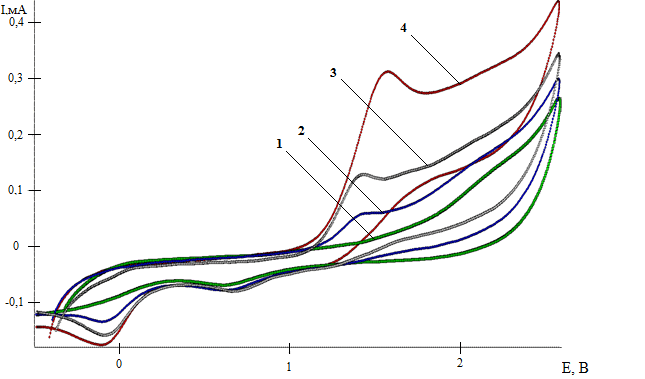
Рис. 2. ЦВА окисления: фонового электролита – 1; циклогептатриена-1,3,5 (С=0,005 М) – 2; циклогептатриена-1,3,5 (С=0,010 М) – 3; циклогептатриена-1,3,5 (С=0,020 М) – 4
(CH3CN, Pt-анод (d=2 мм), Ag/AgCl, 0,15М n-Bu4NСlO4, ʋ = 0,2 В/с)
Электросинтез с участием циклогептатриена-1,3,5 и H2S (мольное соотношение 1:7) проводили в СH3CN в течение 90 мин, в условиях окислительной активации сероводорода и потенциостатическом режиме (1,9 В). По окончанию реакции на ЦВА фиксировали 3 анодных пика, отвечающие образованию серосодержащих продуктов реакции: 6,6’-дисульфанилбис(циклогептандитиола-1,4) 1, циклогептен-4-дитиола-1,3 2, циклогептантриола-1,3,5 3 (рис. 2).
Рис. 3. ЦВА окисления: фонового электролита – 1; циклогептатриена-1,3,5 (С=0,005 М) – 2; продуктов электролиза смеси (циклогептатриен-1,3,5+H2S) при мольном соотношении 1:7 – 3
(CH3CN, Pt-анод (S=70 мм2), Ag/AgCl, 0,15М n-Bu4NСlO4, τ=90 мин, Еэл=1,9 В)
На первой стадии превращений тиильный радикал, генерируемый из молекулы H2S в ходе электролиза, атакует ненасыщенный алициклический углеводород с образованием соответствующего радикала и продукта моноприсоединения тио-группы по кратной связи циклогептатриена-1,3,5 (схема 2).
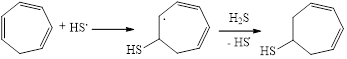 (2)
(2)
В смеси серосодержащих продуктов реакции не обнаружили присутствие циклогептадиен-3,5-тиола-1, который легко участвует в последующей стадии реакции тиоприсоединения тиильного радикала к диеновой системе с образованием соединения 2 (схема 3).
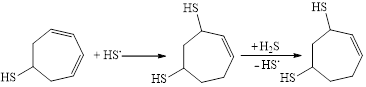 (3)
(3)
Далее реакция SH-функционализации циклогептатриена-1,3,5 по радикальному механизму протекает аналогично дитиолированию и ведет к получению соединения 3, способного при потенциале проведения электролиза к одноэлектронному окислению по атому серы тиогруппы до сероцентрированных радикалов с последующей их димеризацией (схема 4).
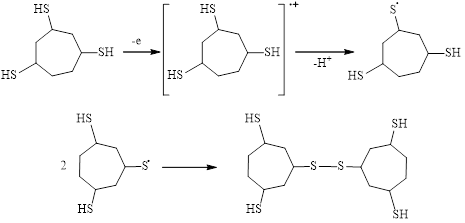 (4)
(4)
Следовательно, рассмотренные превращения представляют собой ряд последовательно-параллельных химических и электрохимических стадий, приводящих к получению серосодержащих продуктов реакции при конверсии циклогептатриена-1,3,5, равной 62,3% (табл. 1).
Таблица 1
Результаты проведения электролиза смеси (циклогептатриен-1,3,5+H2S) при мольном соотношении 1:7 (CH3CN, Pt-анод (S=70 мм2), Ag/AgCl, 0,1М n-Bu4NСlO4, τ = 90 мин, Еэл=1,9 В)
|
Соединение |
Eпа, В |
Iпа, мкА |
η, % |
|---|---|---|---|
|
1 |
1,56 |
90 |
17,7 |
|
2 |
1,72 |
71 |
27,5 |
|
3 |
1,90 |
53 |
25,0 |
Примечание: Eпа – потенциал пика анодного, Iпа – ток пика анодного, η – п
На следующем этапе исследований была произведена оценка влияния тиогрупп на варьирование биологической активности (БА) алициклического соединения. Для расчетов применяли программу PASS, позволяющую установить потенциальную БА с определенной вероятностью (%) (табл. 2).
Таблица 2
Результаты компьютерного прогнозирования различных видов потенциальной биологической активности циклогептатриена-1,3,5 и продуктов его моно-, ди- и тритиолирования (программа PASS)
|
Соединение |
Виды биологической активности |
|---|---|
|
Лечение фобических расстройств (91%) | |
|
Ингибитор тестостерона 17бета-дегидрогеназы (НАДФ +)(90,7%) | |
|
Антагонист никотинового альфа2-бета2-рецептора (89,7%) | |
|
Ингибитор сахарофосфатазы (88,6%) | |
|
Ингибитор клеточной адгезии (88,4%) | |
|
Противоопухолевое (рак матки) (81,3%) | |
|
Ингибитор супероксид-дисмутазы (81,4%) | |
|
Ингибитор НАДФ-пероксидазы (80,1%) | |
|
Лечение фобических расстройств (78,4%) | |
|
Мукомембранный протектор (76,4%) | |
|
Ингибитор нейтрофильной коллагеназы (99,6%) | |
|
Ингибитор НАДФ-пероксидазы (80,1%) | |
|
Противоопухолевое (рак матки) (78,6%) | |
|
Ингибитор тестостерона 17бета-дегидрогеназы (НАДФ+) (79,1%) | |
|
Ингибитор супероксид-дисмутазы (77,1%) | |
|
Ингибитор нейтрофильной коллагеназы (99,7%) | |
|
Ингибитор супероксид-дисмутазы (87,5%) | |
|
Антагонист никотинового альфа4-бета4-рецептора (86,8%) | |
|
Ингибитор матричной металлопротеиназы (82,9%) | |
|
Ингибитор НАДФ-пероксидазы (82,8%) |
На основании полученных расчетных данных можно сделать вывод о том, что введение тио-группы в алицикл С7 способствует повышению его биологической активности, так как циклогептадиен-3,5-тиол-1 и циклогептаен-4-дитиол-1,3 обладают противоопухолевым действием в отличие от циклогептатриена-1,3,5 и его тризамещенного тиопроизводного.
Таким образом, в работе предложен эффективный способ утилизации сероводорода посредством анодной активации в биологически активные продукты тиолирования циклогептатриена-1,3,5 и симметричные дисульфиды, отличающийся экологической безопасностью, низкими энергозатратами и мягкими условиями проведения электрохимического процесса.
Работа выполнена при поддержке РНФ (грант №20-13-00084)

.png&w=640&q=75)