Проблема промышленного получения кормовой протеинсодержащей добавки для балансировки по аминокислотам и витаминам рационов сельскохозяйственных животных, птиц и рыб, с закрытием в СССР 7 крупных биозаводов, выпускавших более 1 млн т белково-витаминного концентрата (БВК) на н-парафинах, а затем на низкосортном зерносырье, стала крайне острой и привела к значительным импортным поставкам белка. Созданная в 1985г. первая отечественная опытно-промышленная установка получения белка из природного газа (гаприна) на Светлоярском заводе БВК обеспечила выпуск ~40тыс т качественного биопродукта с высоким содержанием протеина (~75%), но была закрыта в 1994г., при этом, заложенные в проект показатели не были достигнуты, в частности, из-за невысокой производительности биореактора и большой затрачиваемой электроэнергии (более 5 тыс. квтч/т продукта) [1].
Данная ситуация обуславливает актуальность создания новых современных биопроизводств, обеспечивающих получение высокопротеиновой биодобавки, содержащей необходимый набор аминокислот и витаминов, при экономической эффективности биопроцесса, в частности, за счет снижения энергозатрат на стадии ферментации в биореакторах. В известных конструкциях биореакторов, разработанных для процессов аэробной ферментации с использованием наиболее доступных жидкофазных субстратов (н-парафины, этанол, метанол, ферментализаты) их массоперенос в клетки обеспечивался путем интенсивного перемешивания и аэрации среды за счет различных типов перемешивающих устройств, эжекторов, циркуляционных насосов и прочих энергозатратных способов [2]. В настоящее время в качестве доступного в больших объемах углеродсодержащего сырья рассматривается метансодержащий газ: природный газ, а также биогаз, получаемый при сбраживании различных органических отходов. Применительно к процессу ферментации на метансодержащем газе нами была проведена оценка перспективности известных биореакторов и сформулированы предварительные задачи для разработки нового промышленного биореактора и процесса при получении белка из газа [3].
Учитывая, что кислород и метан являются трудно растворимыми в воде газами, и растворимость при оптимальной температуре ферментации метанокисляющих микроорганизмов (40-45 оС) составляет около 0,021–0,023 об/об., а их потребление микроорганизмами осуществляется в растворенном в культуральной жидкости виде, задача обеспечения интенсивного массопереноса О2 и СН4 из газовой фазы в жидкость и в клетки крайне важна. Схему транспорта кислорода (аналогично метана) из газовой фазы в жидкую и в клетки иллюстрирует рис.1.
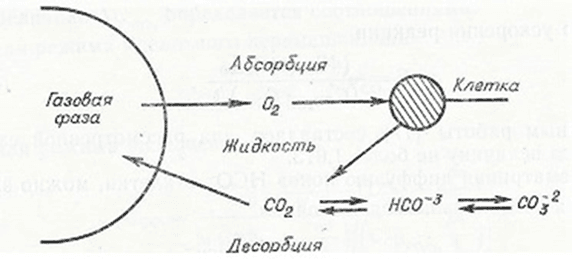
Рис. 1. Схема массопереноса О2 из газа и десорбции СО2 в ферментационной среде
Скорость изменения концентрации кислорода dC/dt (аналогично уравнение справедливо и для метана) в процессе ферментации имеет вид:
dC/dt = kLa (C* - CL) - qO2,
где: C* - равновесная концентрация О2, определяемая согласно закону Генри,
CL – концентрация растворенного О2 при данном парциальном давлении кислорода,
kLa – объемный коэффициент массопередачи О2.
Скорость потребления кислорода микроорганизмами (qO2) непосредственно связана со скоростью роста клеток (µ) и их концентрацией (x):
qO2 = αO2 (dx / dt) = α O2 µ x,
где αO2 – стехиометрический коэффициент потребления О2 клетками.
Для установившегося непрерывного процесса ферментации можно записать:
kLa (C* - CL ) = qO2,
Отсюда следует, что величина Мо2 = kLa (C* - CL) определяет количество переданного кислорода из газа в жидкость, характеризует скорость потребления кислорода клетками и следовательно скорость их роста в условиях перемешивания и аэрации ферментационной среды в биореакторе, и как результат определяет удельную продуктивность процесса (µ x) и производительность (µ x V) биореактора (кг биомассы в час), где V (м3) –рабочий объем биореактора. Таким образом, актуальна задача увеличения Мо2.
Известен и используется на практике способ влияния на движущую силу массопереноса (C*-CL) путем увеличения давления в аппарате. Однако, ограничением этого метода интенсификации является увеличивающееся с давлением ингибирующее влияние растворенного СО2 (согласно схеме рис.1) при достижении определенного для конкретного штамма микроорганизмов значения. Величина kLa – объемного коэффициента массопередачи кислорода зависит от коэффициента массоотдачи (kL, 1/час) – межфазной турбулентности и от удельной поверхности контакта фаз газ-жидкость (a, м2/м3). Теоретический анализ данных величин, определяющих массообмен в системе газ-жидкость детально анализируется в работах академика В.В. Кафарова [4].
Практически интересен вопрос экспериментального исследования эффекта межфазной турбулентности и переноса кислорода в биологической среде, рассмотренный нами в работе [5] с применением метода голографической интерферометрии. Ниже представлены полученные нами экспериментальные результаты, выполненные на биологической и модельной средах с получением интерферограмм и измерением по ним гидродинамического и диффузионных слоев. При этом, величину коэффициента массоотдачи (kL) определяли по скорости движения полос и по движению турбулентного фронта при абсорбции О2 водой и биологической культуральной жидкостью. На графике рис. 2 приведены результаты дискретного измерения деформации полос для абсорбции О2 водой.

Рис. 2. Интерферограмма развития межфазной турбулентности и деформации пограничного слоя при абсорбции О2 в водной среде (фиксация изменения полос на фотографиях через 10 сек.)
Проведенными испытаниями было показано, что добавление в ферментационную среду некоторых поверхностно-активных веществ (ПАВ) способствует интенсификации процесса ферментации [6]. Анализ интерферограмм при добавлении в среду выбранных ПАВ, подтверждает их влияние на межфазную турбулентность при абсорбции О2. Так, добавление в культуральную жидкость ПАВ №2 (проксанол), согласно интерферограммам приведенным на рис.3 приводит к ощутимой деформации интерференционных полос по глубине слоя, при этом поверхность раздела фаз газ-жидкость заметно малоподвижна, что замедляет межфазный переход кислорода.

Рис. 3. Интерферограмма развития межфазной турбулентности и деформации пограничного слоя при абсорбции О2 в водной среде с добавлением ПАВ №2 (фиксация изменения полос на фотографиях с дискретностью 5 сек.)
В то же время из интерферграмм, приведенных на рис. 4 наглядно следует, что добавление ПАВ №3 (блоксополимер окиси этилена и окиси пропилена) привело к значительной деформации интерференционных полос по сечению слоя, что обуславливает ускоренный перенос О2 внутрь жидкости. Непосредственно у границы раздела фаз газ-жидкость наблюдаются заметные колебания слоя, в отличие от спокойной картины раздела фаз для системы без добавления ПАВ (рис. 2). Скорость изменения структуры слоя во времени при добавлении в среду ПАВ №3 существенно выше, чем при абсорбции водой. Полученные данные показывают высокую межфазную турбулентность и ускорение массопереноса О2 в слой жидкости при использовании ПАВ №3
 Рис. 4. Интерферограмма развития межфазной турбулентности и деформации пограничного слоя при абсорбции О2 в водной среде с добавлением ПАВ №3 (фиксация изменения полос на фотографиях с дискретностью 5 сек.)
Рис. 4. Интерферограмма развития межфазной турбулентности и деформации пограничного слоя при абсорбции О2 в водной среде с добавлением ПАВ №3 (фиксация изменения полос на фотографиях с дискретностью 5 сек.)
На графике рис.5 приведены результаты математической обработки полученных интерференционных картин по влиянию ПАВ на скорость массопереноса О2 и проведен расчет в сравнении с результатами, полученными в воде без добавления ПАВ (0 %).
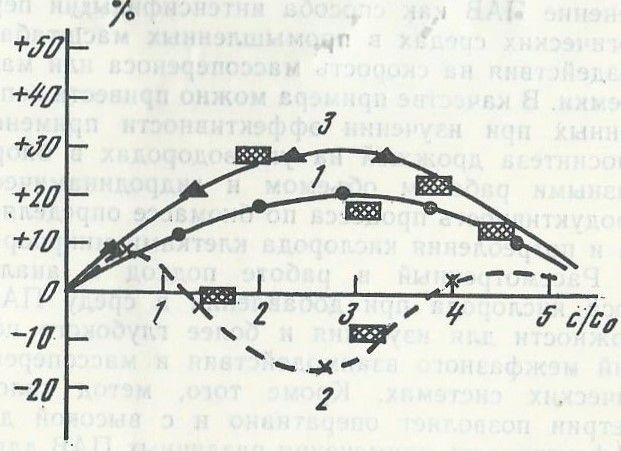
Рис. 5. Сравнительный анализ влияния различных ПАВ на скорость абсорбции О2 (1 - ПАВ №1, 2 - ПАВ № 2, 3 - ПАВ №3)
Цель и результат проведенных исследований состоял в теоретическом и экспериментальном обосновании интенсификации процесса массопереноса кислород за счет добавления в культуральную жидкость определенного поверхностно-активного вещества, в качестве которого был отобран ПАВ №3. При этом, отмеченный в лабораторных, а затем в промышленных испытаниях эффект повышения производительности процесса аэробной ферментации в биореакторе в среднем на 23 % без увеличения вкладываемой мощности определяет значительный экономический эффект. Данный метод увеличения скорости массопередачи двух труднорастворимых газов: метана и кислорода без дополнительных энергозатрат в биореакторе имеет определенное экономическое значение для повышения эффективности ферментационного процесса получения белковой биомассы при ферментации метанутилизирующих бактерий.

.png&w=640&q=75)