Введение
В настоящее время активно идет развитие междисциплинарного направления биопечати, которое сосуществует на стыке биотехнологии, физики и медицины. Биопринтинг находит применение в регенеративной медицине [2], фармакологии при тестировании лекарственных препаратов на искусственно сформированных биологических тканях и восходящий тренд развития биопринтинга показывает, что в перспективе подобные технологии найдут место и во многих других индустриях. Процесс биопечати основан на слаженном взаимодействии трех ключевых компонентов.
Первым компонентом являются технологии аппаратно-программной реализации процесс биопечати. Здесь происходит реализация биопринтера как технологического объекта и его программного обеспечения. В этой области важно реализовать точное позиционирование устройства печати и бесперебойную подачу исходного материала для формирования структуры будущих биологических тканей.
Вторым компонентом является комплекс подходов и технологий для управления процессом роста клеток, обеспечивающих их устойчивое развитие. Учитывая, что для роста и жизнедеятельности клеток необходимо выполнение целого комплекса условий, таких как: определенный температурный режим, подача питательных веществ, своевременный отвод продуктов их жизнедеятельности, а также исключение контакта с вредными факторами, например ультрафиолетовое излучение и токсичные вещества.
Таким образом для успешной реализации технологий биопечати необходим третий компонент – промежуточная среда, которая позволит защитить клетки от вредных воздействий. Такие материалы в технологии биопечати именую биочернилами [3]. В роли таких биочернил используются различные полимерные структуры, такие как плюроники [5] и гели [4]. Такие вещества должны обладать рядом свойств, чтобы быть примененными в технологии биопечати: обладать достаточными диффузионными и фильтрующими свойствами, позволяющими с одной стороны защитить клетки, помещенные в такой материал от нежелательных воздействий окружающей среды, а с другой стороны позволять подвод питательных веществ [6]. Также важным параметром является прочность материала, так как в процессе биопринтинга могут формироваться довольно сложные структуры и для сохранения их структуры материал должен обладать достаточной прочностью. Особый интерес представляет агарозный гель. С одной стороны он является сравнительно доступным материалом и при этом уже находит применение в задачах биопринтинга. Однако требуется более детальное исследование данного материала в контексте его массопроводных свойств.
Целью данной работы является проведение экспериментального исследования по определению интенсивности испарения жидкости из агарозного геля. Агароза представляет из себя систему полимерных цепочек, пространство между которыми заполнено жидкостью. Также важно отметить, что жидкость играет важную роль в обеспечении функционирования клеток, помещенных в гель. Поэтому важно определить интенсивность и степень потери жидкости из геля. Наибольшее количество жидкости гель теряет в первые часы после формирования гелевого объекта.
Объекты и методы исследования
Постановка эксперимента является комплексным процессом, для решения которого необходима декомпозиция исходной задачи. Основной целью эксперимента является фиксация потери влаги гелем. Таким образом первостепенной задачей является определение метода фиксации изменения влаги в геле. Для этого в эксперименте были использованы электронные лабораторные весы. Второй задачей встал вопрос о методе хранения геля в процессе эксперимента. Для лучшего понимания динамики испарения жидкости с поверхности геля необходимо обеспечить максимальный контакт поверхности геля с атмосферой. Для это цели была использована чашка Петри – лабораторная посуда, широко используемая при проведении исследовательских и практических работ в области химии, биотехнологии и медицины. Непосредственно после формирования гелевого образца его температура может достигать значений до 60 °C. Учитывая, что поверхность лабораторных весов металлическая и обладает хорошей теплопроводностью, необходима теплоизоляция чашки Петри с горячим гелем от поверхности весов. В роли теплоизоляции была использована пластина из пеноплистирола. Учитывая, что нагретый гель будет отдавать тепло окружающей среды было принято решения фиксировать также и изменение температуры с помощью термопары. Хотя изучение теплофизических свойств геля выходит за рамки данного эксперимента, сбор данных об изменении температуры геля позволит создать основу для проведения дальнейших экспериментальных и численных исследований свойств геля.
Одной из сложностей исследования гелевых материалов является то, что их массопроводные и теплофизические свойства могут меняться в зависимости от концентрации исходного гелевого материала (обычно в порошкообразной форме) в процессе его формирования. Таким образом необходимо также определиться в тем, какие концентрации агарозного геля будут использованы для формирования гелевых образцов, которые формируются путем смешивания геля в порошкообразной форме с водой при температурах порядка 80 °C. В рамках данной работы были использованы гелевые образцы с массовой концентрацией агарозного геля 0.6 и 1%. Выбор таких концентраций обусловлен тем, что такие концентрации с одной стороны обеспечивают достаточные прочностные свойства гелевого образца, с другой стороны сохраняются массопроводные свойства позволяющие поддерживать нормальную жизнедеятельность клеток внутри геля. Повышение концентрации выше 1 % хотя и повышает его прочностные свойства, но приводит к существенному ухудшению его массопроводных свойств, в то время как снижение концентрации ниже 0.6 % затрудняет формирование цельной структуры [6].
Экспериментальная часть
Экспериментальная установка представлена на рисунке (рис. 1). Установка включает в себя электронные весы (5), на которые устанавливалась чашка Петри (3) с нанесённым слоем геля (1). В гель помещалась термопара (2) для измерения температуры. При этом поверхность чашки Петри была изолирована от площадки весов с помощью теплоизолирующей пластины из пенопласта (4) с целью исключения тепловых потерь при контакте ёмкости с площадкой весов.
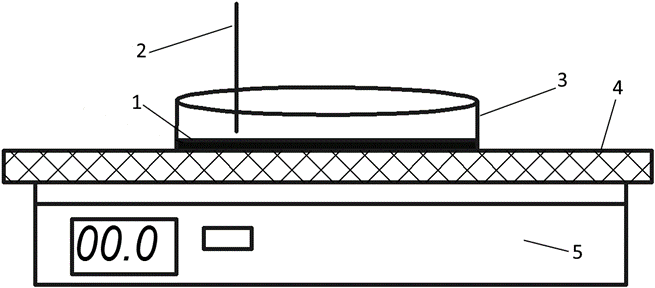
Рис. 1. Экспериментальная установка: 1 – слой агарозного геля, 2 – термопара, 3 – чашка Петри, 4 –теплоизолирующая пластина, 5 – электронные весы
В экспериментальном исследовании использовался агарозный гель концентрацией 0,6 и 1%. Процесс выполнения эксперимента состоял из ряда этапов. Гель заданной концентрации смешивался с водой и подогревался до температуры 80 °C. Затем гель остывал до 60 °C и наносился на поверхность чашки Петри. Далее чашка устанавливалась на теплоизолирующую пластину на площадке весов. На следующем шаге в гель вводилась термопара. Перед началом эксперимента включался таймер для отсчёта времени. Изменения показаний электронных весов фиксировались в таблице с соответствующим значением времени по таймеру. На основе полученных данных была получена зависимость изменения массы геля от времени (рис. 2).
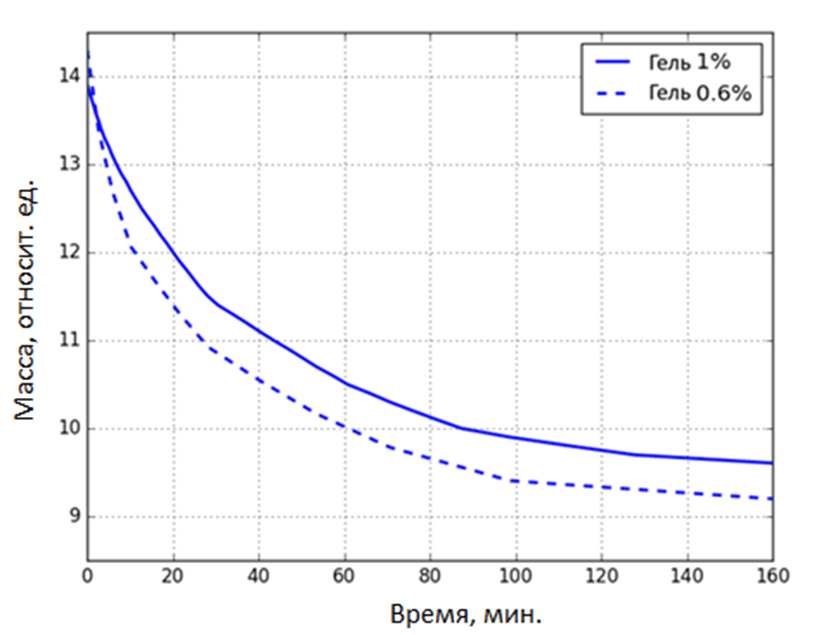
Рис. 2. Динамика испарения геля во времени при концентрациях 0.6 и 1 %
Фиксация изменений массы и температуры производилась в течение 2 часов 40 минут. Учитывая нелинейный характер интенсивности испарения жидкости с поверхности геля, шаг снятия показания менялся в процессе выполнения эксперимента. В первые 20 минут шаг составлял 30 секунда, с 20 минут до 40 минут снятие показание осуществлялось каждые 2 минуты и далее до конца эксперимента шаг составлял 4 минут ввиду существенного снижения интенсивности испарения жидкости. Данный временной интервал позволяет зафиксировать характерные стадии формирования и старения геля, включая начальную стадию формирования структуры и его полимеризации.
Выводы
В первые 20 минут эксперимента наблюдается линейная зависимость изменения массы геля во времени. Такой характер зависимости может быть связан с тем, что в данный период идёт формирование геля и испарение жидкости производится с поверхности геля, при этом возможен подвод жидкости из глубинных слоёв геля за счёт действия капиллярных сил. В интервале от 20 минут до 2 часов характер зависимости становится нелинейным, что может быть обусловлено действием дополнительных факторов на процесс испарения, таких как процесс усадки геля. После 2 часов наблюдается стабилизация процесса испарения. Причина стабилизации может быть связана с тем, что оставшейся жидкости недостаточно для действия капиллярных сил для подвода жидкости к поверхности геля, что приводит к тому, что процесс испарения продолжается внутри пор, где суммарная поверхность испарения меньше в сравнении с поверхностью геля.

.png&w=640&q=75)