Актуальность исследования
Актуальность исследования определяется тем, что цитологические методы остаются одним из наиболее доступных и быстрых способов морфологической диагностики в условиях ограниченного объема материала и необходимости оперативного клинического решения. Однако в ряде ситуаций возможностей цитоморфологии недостаточно: реактивные и неопластические изменения могут иметь сходные признаки, опухоли различных линий дифференцировки нередко демонстрируют «перекрывающиеся» цитологические картины, а доля категорий «атипия/подозрение» сохраняется клинически значимой, поскольку ведет к неопределенности маршрутизации пациента и риску как гипердиагностики, так и пропуска злокачественного процесса. В этих условиях иммуноцитохимическое исследование выступает наиболее практичным и широко применяемым вспомогательным методом, позволяющим подтвердить или уточнить природу клеточной популяции и тем самым повысить точность верификации цитологических заключений, особенно когда иной диагностический материал отсутствует или его получение сопряжено с задержкой и инвазивностью.
Дополнительную клиническую значимость ИЦХ приобретает в онкологической практике, где от достоверности морфологической верификации и корректного определения фенотипа опухоли напрямую зависят выбор лечебной тактики, объем хирургического вмешательства, необходимость повторной биопсии и возможность назначения таргетной и иммунотерапии; при этом современная парадигма требует рационального использования ограниченного образца и стандартизированного контроля качества лабораторных методик. Именно поэтому профессиональные рекомендации акцентируют внимание на аналитической валидации иммунологических тестов, применяемых на малом материале и клеточных блоках, а также на соблюдении требований к пригодности образца для интерпретации результатов.
Таким образом, исследование клинической значимости иммуноцитохимии в верификации цитологических диагнозов является актуальным как с позиции повышения диагностической достоверности и воспроизводимости заключений, так и с позиции обеспечения клинически обоснованных решений в условиях дефицита ткани, роста числа сложных дифференциально-диагностических задач и усиления требований к качеству и стандартизации морфологической диагностики.
Цель исследования
Цель данного исследования – оценить клиническую значимость иммуноцитохимического исследования в верификации и уточнении цитологических диагнозов и сформулировать принципы алгоритмического выбора иммуномаркеров для практического применения в условиях ограниченного цитологического материала.
Материалы и методы исследования
Проведён аналитический обзор и систематизация данных по вопросам верификации цитологических диагнозов и применению ИЦХ: использованы положения стандартизированных систем отчётности, обобщены клинические сценарии применения ИЦХ, а также сформулированы принципы панельного подбора иммуномаркеров и критерии контроля достоверности окрашивания.
Методами исследования являлись сравнительно-аналитический и логико-структурный анализ.
Результаты исследования
В современной морфологической диагностике цитологический материал часто является первичным (а иногда и единственным) морфологическим «окном» в патологический процесс, поэтому методологически важны два принципа:
- Сопоставимость заключений между лабораториями и клиницистами за счет единых терминологических систем;
- Подтверждаемость (верифицируемость) ключевых решений, прежде всего в «пограничных» категориях, где риск клинической ошибки максимален.
Базой для воспроизводимости цитологических диагнозов служат стандартизированные системы отчетности, которые связывают диагностическую категорию с вероятностной оценкой риска злокачественности (или риска высокозлокачественного процесса) и типичной клинической тактикой. Эти системы методологически важны не только как «язык общения», но и как инструмент управляемой неопределенности: они фиксируют, где цитоморфология объективно не дает однозначного ответа, и где требуется подтверждение дополнительными методами. Показательным примером является пересмотренная система Bethesda для цитологии щитовидной железы, в которой для каждой категории приведены интервальные риски злокачественности, причем отдельно показано, как меняются оценки при разном учете NIFTP (неинвазивного фолликулярного новообразования с папилляроподобными ядерными признаками) (табл. 1).
Таблица 1
Категории Bethesda и подразумеваемый риск злокачественности (ROM), % (с управленческой привязкой) [4]
Диагностическая категория | ROM, если NIFTP не считается карциномой | ROM, если NIFTP считается карциномой | Типичная тактика (по системе) |
Недиагностический/неудовлетворительный | 5-10 | 5-10 | Повторная ТАБ под УЗ-навигацией |
Доброкачественный | 0-3 | 0-3 | Клиническое и УЗ-наблюдение |
Атипия неопределенного значения / фолликулярное поражение неопределенного значения | 6-18 | 10-30 | Повторная ТАБ, молекулярное тестирование или лобэктомия |
Фолликулярная неоплазия / подозрение на фолликулярную неоплазию | 10-40 | 25-40 | Молекулярное тестирование, лобэктомия |
Подозрение на злокачественность | 45-60 | 50-75 | Тиреоидэктомия/лобэктомия (в зависимости от контекста) |
Злокачественный | 94-96 | 97-99 | Тиреоидэктомия/лобэктомия (если речь о первичной опухоли) |
Для других локализаций аналогичную методологическую роль выполняют системы, ориентированные на клинически значимый «таргет» диагноза. Например, Парижская система для мочевой цитологии фокусирует оценку на выявлении high-grade уротелиальной карциномы и поэтому использует показатель ROHM (риск наличия карциномы высокой степени злокачественности). На уровне доказательной базы полезны метааналитические оценки, позволяющие видеть, как меняется риск в зависимости от категории при агрегировании международных данных; это задает рамку для того, в каких категориях верификация особенно оправдана и где она будет иметь максимальный клинический эффект [5].
Для понимания диагностических возможностей иммуноцитохимического исследования принципиальное значение имеет иммунологическая природа метода, основанная на высокоспецифическом взаимодействии антигена, экспрессируемого клетками исследуемого материала, и соответствующего антитела. Специфичность данного взаимодействия определяется структурной организацией иммуноглобулинов, в которой вариабельные домены формируют сайт связывания антигена, тогда как константные участки обеспечивают последующую визуализацию реакции с использованием систем детекции. Структурные элементы молекулы антитела, обеспечивающие селективность иммунной реакции, представлены на рисунке 1.
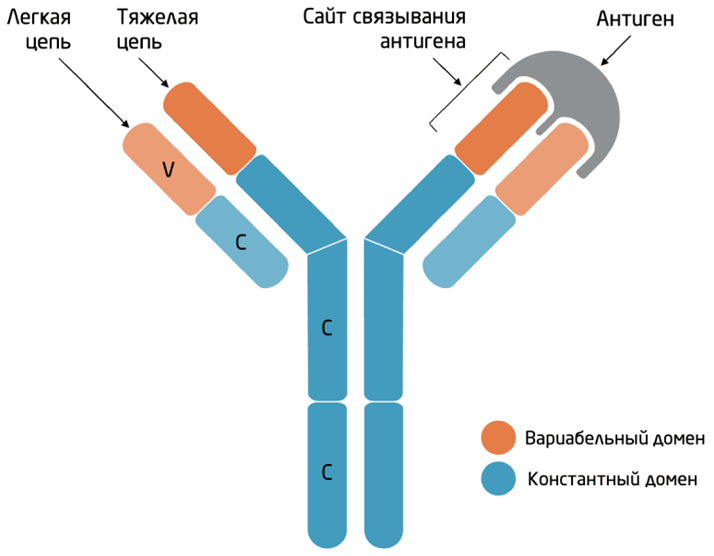
Рис. 1. Схема строения иммуноглобулина: вариабельные и константные домены, тяжелые и легкие цепи, участок связывания антигена [1]
В ряде клинических ситуаций одной цитоморфологии недостаточно из-за перекрывающихся признаков реактивных и опухолевых процессов либо из-за невозможности уверенно установить тканевую принадлежность опухоли при малом количестве клеток. В таких условиях ИЦХ повышает достоверность заключения за счёт фенотипирования клеточной популяции и сопоставления иммунного профиля с клинико-радиологическими данными; наибольшая практическая ценность метода проявляется в «пограничных» категориях и при высоких рисках клинической ошибки.
Особенно показательно применение ИЦХ при исследовании серозных выпотов, где морфологическая картина реактивного мезотелия, мезотелиомы и метастатической аденокарциномы может существенно перекрываться. Использование панелей маркеров позволяет подтвердить мезотелиальную или эпителиальную природу клеток и тем самым влияет на стадирование, маршрутизацию и выбор лечения; при этом в источниках открытого доступа подчёркивается, что интерпретация должна основываться на совокупности маркеров, а не на единичном тесте (рис. 2).
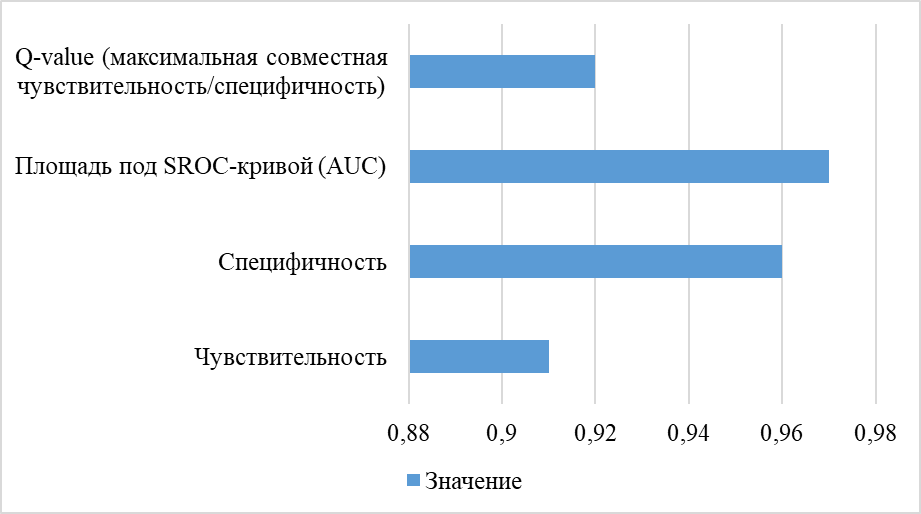
Рис. 2. Диагностическая точность кальретинина при дифференциации мезотелиомы и метастатической карциномы в серозных выпотах [3]
На сегодняшний день клиническая роль ИЦХ в цитологии расширилась за счёт предиктивных тестов, влияющих на выбор терапии. Для немелкоклеточного рака лёгкого показана сопоставимость определения PD-L1 на цитологических образцах демонстрирует высокие значения чувствительности и специфичности как для порога TPS ≥ 1%, так и для TPS ≥ 50%, что обосновывает применение цитологии при условии соблюдения преаналитических требований и контроля качества [2].
В ситуациях выявления опухолевых клеток при метастатическом поражении (пунктаты лимфоузлов, выпоты) ИЦХ помогает сузить круг вероятных первичных локализаций и рационально построить дальнейшее обследование, уменьшая диагностические задержки. В целом ИЦХ в цитологии клинически значима как метод повышения подтверждаемости диагнозов при дефиците ткани, снижения неопределённости заключений и обеспечения более обоснованных решений о лечении.
Алгоритмы и принципы выбора иммуномаркеров для верификации цитологических диагнозов основаны на рациональном использовании ограниченного клеточного материала и на снижении риска диагностических ошибок при морфологически сходных процессах. Выбор маркеров строится по логике «от общего к частному»: сначала устанавливают линию дифференцировки клеточной популяции, затем уточняют нозологический вариант и при необходимости предполагаемый первичный очаг. Применение единичного маркера не обеспечивает надёжной верификации, поэтому рабочей единицей является панель, где решение принимается по согласованному иммунному профилю с учётом клинических данных и морфологической картины.
На первом шаге используют маркеры, позволяющие разделить основные группы опухолей и опухолеподобных процессов: эпителиальные, лимфоидные, меланоцитарные, мезенхимальные, нейроэндокринные. Это сокращает диагностический диапазон и помогает избежать ошибочной интерпретации «атипии» как конкретной нозологии. На втором шаге добавляют уточняющие маркеры, которые дифференцируют близкие варианты внутри подтверждённой линии. При подозрении на метастатический процесс цель ИЦХ – не «назвать орган» по одному антителу, а сформировать наиболее вероятные направления поиска первичного очага, которые затем проверяются клинически и инструментально.
Таблица 2
Пример базовых и уточняющих иммуномаркеров, применяемых в цитологической верификации (разработка автора)
Диагностическая задача | Базовые маркеры | Уточняющие маркеры |
Подтверждение эпителиальной природы | Цитокератины (AE1/AE3, PAN-CK) | CK7, CK20 |
Подозрение на мезотелиальную дифференцировку | Кальретинин, WT-1 | D2-40 |
Лимфоидная природа клеток | CD45 | CD20, CD3 |
Подозрение на меланоцитарную опухоль | S-100 | HMB-45, Melan-A |
Поиск вероятного первичного очага | CK7/CK20 | TTF-1, PAX8, GATA3, CDX2 |
Критической частью алгоритма является контроль достоверности результата. Для каждого иммунного окрашивания оценивают наличие контрольных элементов и соответствие ожидаемому паттерну (локализация сигнала, интенсивность, доля окрашенных клеток). При несостоятельности контроля результат не используют для клинического вывода, поскольку ошибка на этом этапе приводит к неверной маршрутизации пациента и повторным инвазивным вмешательствам. Набор маркеров выбирают с учётом формата цитологического материала (мазок, жидкостная цитология, клеточный блок) и ожидаемого диагностического вопроса; избыточные панели снижают информативность из-за расхода материала и увеличивают риск противоречивых частных результатов.
Переходя от обоснования клинической значимости иммуноцитохимического исследования к прикладным вопросам, целесообразно сформулировать практические рекомендации, которые обеспечивают воспроизводимость результата и его прямую полезность для принятия клинических решений.
Для клинической практики рекомендуется направлять материал на ИЦХ в ситуациях диагностической неопределённости (категории «атипия», «подозрение»), при расхождении цитологической картины с клинико-радиологическими данными, при подозрении на метастатическое поражение или неясный первичный очаг, а также при необходимости получения предиктивных показателей, влияющих на выбор терапии. В направлении следует указывать клинический вопрос, локализацию, данные визуализации, сведения о ранее установленной опухоли и проведённом лечении, поскольку это определяет рациональный подбор панели и сокращает расход материала.
Для лабораторной практики приоритетны стандартизация преаналитики (тип фиксации, маркировка, достаточная клеточность, предпочтение клеточного блока при планируемой ИЦХ), панельный принцип постановки маркеров по алгоритму «от общего к частному», обязательное использование контролей и фиксирование в протоколе условий окрашивания и критериев интерпретации. В заключении ИЦХ следует описывать маркеры, паттерн окрашивания (локализация, интенсивность, доля клеток), ограничения материала и итоговый вероятностный вывод, формулируя его в терминах, напрямую понятных клиницисту и позволяющих выбрать дальнейшую тактику.
Выводы
Иммуноцитохимическое исследование является клинически значимым инструментом повышения достоверности цитологических заключений прежде всего в ситуациях диагностической неопределённости и дефицита ткани. Наибольший эффект достигается при применении панелей маркеров, выстроенных по алгоритму «от общего к частному», с учётом формата препарата (мазок, жидкостная цитология, клеточный блок) и обязательным контролем качества. Стандартизированные системы отчётности, связывающие категории цитологического заключения с риском злокачественности и тактикой ведения, обеспечивают сопоставимость и управляемость решений, а ИЦХ дополняет их, повышая подтверждаемость диагноза, снижая долю «пограничных» заключений и поддерживая клинически обоснованный выбор диагностической и лечебной стратегии, включая случаи, где результат влияет на подбор терапии.

.png&w=640&q=75)